题目内容
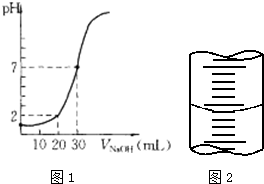 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:(1)有关滴定的操作可分解为如下几步,并补充完整.①用NaOH溶液润洗滴定管.②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3mL.
③
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果
(3)如用酚酞作指示剂,则滴定终点的实验现象是
(4)c(HCl)=
(5)c(NaOH)=
(6)如图2表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)
A.是a mL B.是(50-a)mL
C.一定大于a mL D.一定大于(50-a)mL
(7)常温下,用0.01mol?L-1H2SO4溶液滴定0.01mol?L-1 NaOH溶液,中和后加水至100ml.若滴定到终点时少加一滴H2SO4(设1滴为0.05ml).则此时溶液的pH为
考点:中和滴定
专题:
分析:(1)装液时,调节滴定管尖嘴使之充满溶液,使管内无气泡;
(2)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,结合c(H+)=
计算酸、碱浓度;
(6)根据滴定管的结构来解答;
(7)根据少滴了1滴H2SO4,溶液呈碱性,抓住过量的OH-求出c(OH-),然后根据水的离子积常数求出c(H+).
(2)根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
(3)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,结合c(H+)=
| c(HCl)×V(HCl)-c(NaOH)×V(NaOH) |
| V(HCl)+V(NaOH) |
(6)根据滴定管的结构来解答;
(7)根据少滴了1滴H2SO4,溶液呈碱性,抓住过量的OH-求出c(OH-),然后根据水的离子积常数求出c(H+).
解答:
解:(1)装液时,把盛有NaOH溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
故答案为:调节滴定管尖嘴使之充满溶液;
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,造成V(待测)偏大,根据c(待测)=
可知,测定c(待测)偏低,故选:偏低;
(3)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
故答案为:最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,c(H+)=
=
=0.01mol/L,所以c(NaOH)=0.03mol/L,c(HCl)=3c(NaOH)=0.09mol/L,
故答案为:0.09;0.03;
(6)由于滴定管下端有一段没有刻度,滴定管中液体的体积一定大于(25-a)mL;
故答案为:D;
(7)少加1滴H2SO4,过量的氢氧根离子的物质的量为0.01mol?L-1×2×0.05×10-3L=1×10-6mol,溶液中c(OH-)=
=10-5 mol?L-1,则c(H+)=
mol?L-1=10-9mol?L-1,此时溶液的pH为9,故答案为:9.
故答案为:调节滴定管尖嘴使之充满溶液;
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,造成V(待测)偏大,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
(3)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
故答案为:最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去;
(4)(5)根据图象知,当V(NaOH)=30mL时,混合溶液呈中性,说明n(HCl)=n(NaOH),盐酸的体积是10mL,氢氧化钠的体积是30mL,则c(HCl)=3c(NaOH),当氢氧化钠溶液体积为20mL时,混合溶液的pH=2,c(H+)=
| c(HCl)×V(HCl)-c(NaOH)×V(NaOH) |
| V(HCl)+V(NaOH) |
| 3C(NaOH)×0.01L-C(NaOH)×0.02L |
| 0.01L+0.02L |
故答案为:0.09;0.03;
(6)由于滴定管下端有一段没有刻度,滴定管中液体的体积一定大于(25-a)mL;
故答案为:D;
(7)少加1滴H2SO4,过量的氢氧根离子的物质的量为0.01mol?L-1×2×0.05×10-3L=1×10-6mol,溶液中c(OH-)=
| 1×10-6mol |
| 0.1L |
| 10-14 |
| 10-5 |
点评:本题考查了酸碱中和滴定操作、误差分析、溶液中氢离子浓度的计算,根据溶液体积确定酸碱浓度关系即可完成,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、100 mL3 mol?L-1的硫酸与100 mL H2O混合,硫酸物质的量浓度改变为1.5 mol?L-1 |
| B、把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数是10% |
| C、把200 mL3 mol?L-1的BaCl2溶液与100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol?L-1 |
| D、把100 mL 20%的NaOH溶液与100 mL H2O混合后,NaOH溶液的质量分数是10% |
现有三组溶液:①汽油和氯化钠溶液、②39%的乙醇溶液、③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
室温下,下列各组离子或分子在指定分散系中能大量共存的是( )
| A、FeCl3溶液中:H+、Na+、Cl-、H2O2 | ||||
| B、酸性KMnO4的溶液中:Na+、NO3-、K+、CH3CH2OH | ||||
| C、混有氯化氢气体的氯气中:O2、CH4、N2、NH3 | ||||
D、c(H+)=0.10mol/L的溶液中:NH
|
 某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: