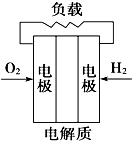
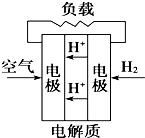
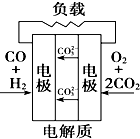
题目内容
在密闭容器中,通入amolN2和bmolH2,在一定条件下达到平衡,容器中还剩余cmolN2.
①生成NH3的物质的量为 .
②平衡时H2的转化率为 .
③若把容器体积减小一半,则正反应速率 ,逆反应速率 ,N2转化率 .
(填“变大”、“变小”、或“不变”)
①生成NH3的物质的量为
②平衡时H2的转化率为
③若把容器体积减小一半,则正反应速率
(填“变大”、“变小”、或“不变”)
考点:化学平衡的计算,化学反应速率的影响因素
专题:
分析:根据方程式计算:
N2 (g)+3H2(g)
2NH3(g),
起始量(mol):a b 0
转化量(mol):a-c 3(a-c) 2(a-c)
平衡(mol):c b-3(a-c) 2(a-c)
据此进行计算;
N2 (g)+3H2(g)
| 催化剂 |
| 高温高压 |
起始量(mol):a b 0
转化量(mol):a-c 3(a-c) 2(a-c)
平衡(mol):c b-3(a-c) 2(a-c)
据此进行计算;
解答:
解:根据方程式计算:
N2 (g)+3H2(g)
2NH3(g),
起始量(mol):a b 0
转化量(mol):a-c 3(a-c) 2(a-c)
平衡(mol):c b-3(a-c) 2(a-c)
①根据以上三段式数据,生成NH3的物质的量为2(a-c)mol,故答案为:2(a-c)mol;
②根据以上三段式数据,平衡时H2的转化率为
,故答案为:
;
③若把容器体积减小一半,则增大压强,所以正反应速率变大,逆反应速率变大,平衡向正反应方向移动,所以N2转化率也变大;故答案为:变大;变大;变大;
N2 (g)+3H2(g)
| 催化剂 |
| 高温高压 |
起始量(mol):a b 0
转化量(mol):a-c 3(a-c) 2(a-c)
平衡(mol):c b-3(a-c) 2(a-c)
①根据以上三段式数据,生成NH3的物质的量为2(a-c)mol,故答案为:2(a-c)mol;
②根据以上三段式数据,平衡时H2的转化率为
| 3(a-c) |
| b |
| 3(a-c) |
| b |
③若把容器体积减小一半,则增大压强,所以正反应速率变大,逆反应速率变大,平衡向正反应方向移动,所以N2转化率也变大;故答案为:变大;变大;变大;
点评:本题考查了化学平衡的计算,题目难度中等,注意掌握化学反应三段式的计算方法,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.

练习册系列答案
相关题目
反应H2(g)+CO2(g)?H2O(g)+CO(g),某温度下该反应的平衡常数K=
.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断正确的是( )
| 9 |
| 4 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A、反应开始时,丙中的反应速率最快,乙中的反应速率最慢 |
| B、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| C、平衡时,甲中和丙中H2的转化率均是60% |
| D、平衡时,乙中CO2的转化率大于60% |
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数( )
| A、42% | B、58% |
| C、36% | D、64% |
将等物质的量的金属Na、Mg、Al分别与100mL 2mol/L的盐酸反应,生成气体的体积均为VL(标准状况下),已知:2Na+2H2O=2NaOH+H2,下列说法错误的是( )
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
下列图象表达正确的是( )


| A、图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1mol/L氨水 |
| B、图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 |
| C、图③表示向CaCl2溶液中通入CO2 |
| D、图④表示向醋酸溶液中滴入氨水 |
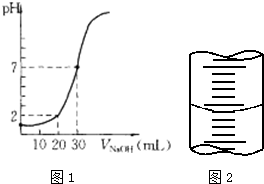 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题: