题目内容
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H 0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 mol?L-1?s-1;反应的平衡常数K1= mol/L.

(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol?L-1?s-1的平均速率降低,经10s又达到平衡.则:
①T 100℃(填“>”或“<”).
②计算温度T时反应的平衡常数K2= mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向 (填“正”或“逆”)反应方向移动.
回答下列问题:
(1)反应的△H

(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol?L-1?s-1的平均速率降低,经10s又达到平衡.则:
①T
②计算温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=
计算得到;化学平衡常数利用化学平衡常数表达式计算;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
| △c |
| △t |
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答:
解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=
=0.0010mol?L-1?s-1;K=
=
=0.36mol/L,故答案为:>;0.0010;0.36;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:>;
②平衡时,c(NO2)=0.120mol?L-1+0.0020mol?L-1?s-1×10s×2=0.16mol?L-1,c(N2O4)=0.040mol?L-1-0.0020mol?L-1?s-1×10s=0.020mol?L-1,K2=
=1.28mol/L,
故答案为:1.28;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆.
| 0.06mol/L |
| 60S |
| c2(NO2) |
| c(N2O4) |
| (0.12mol/L)2 |
| 0.04mol/L |
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:>;
②平衡时,c(NO2)=0.120mol?L-1+0.0020mol?L-1?s-1×10s×2=0.16mol?L-1,c(N2O4)=0.040mol?L-1-0.0020mol?L-1?s-1×10s=0.020mol?L-1,K2=
| (0.16mol/L)2 |
| 0.020mol/L |
故答案为:1.28;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、100mL0.1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4 L |
| D、48gO2和O3的混合气体中氧原子数目为3NA |
在室温下,下列叙述正确的是( )
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+H2O=2NaOH+H2 |
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
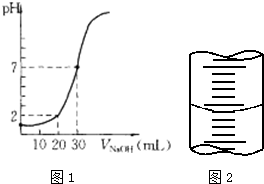 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.