题目内容
下列说法正确的是( )
| A、100 mL3 mol?L-1的硫酸与100 mL H2O混合,硫酸物质的量浓度改变为1.5 mol?L-1 |
| B、把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数是10% |
| C、把200 mL3 mol?L-1的BaCl2溶液与100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol?L-1 |
| D、把100 mL 20%的NaOH溶液与100 mL H2O混合后,NaOH溶液的质量分数是10% |
考点:物质的量浓度的相关计算
专题:
分析:A.硫酸的密度大于水的密度,等体积混合,总体积小于200mL;
B.和水混合前后,NaCl的质量不变;
C.根据混合前后溶液中n(Cl-)不变,结合c=
计算;
D.根据质量分数w=
分析计算,和水混合后,NaOH的质量不变,但溶液质量未知.
B.和水混合前后,NaCl的质量不变;
C.根据混合前后溶液中n(Cl-)不变,结合c=
| n |
| v |
D.根据质量分数w=
| m溶质 |
| m溶液 |
解答:
解:A.硫酸的密度大于水的密度,等体积混合,总体积小于200mL,则把100mL3mol?L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度大于1.5mol?L-1,故A错误;
B.和水混合前后,NaCl的质量不变,则把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是
×100%=10%,故B正确;
C.把200 mL3 mol?L-1的BaCl2溶液n(Cl-)=0.2L×3mol/L×2=1.2mol,100 mL 3 mol?L-1的KCl溶液n(Cl-)=0.1L×3mol/L=0.3mol,混合后,溶液中的c(Cl-)=
=5 mol?L-1,故C错误;
D.质量分数w=
,100 mL 20%的NaOH溶液溶液质量未知,无法求算,故D错误;
故选B.
B.和水混合前后,NaCl的质量不变,则把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是
| 100g×20% |
| 100g+100g |
C.把200 mL3 mol?L-1的BaCl2溶液n(Cl-)=0.2L×3mol/L×2=1.2mol,100 mL 3 mol?L-1的KCl溶液n(Cl-)=0.1L×3mol/L=0.3mol,混合后,溶液中的c(Cl-)=
| 1.2mol+0.3mol |
| 0.3L |
D.质量分数w=
| m溶质 |
| m溶液 |
故选B.
点评:本题考查质量分数和物质的量浓度的计算,把握公式为解答的关键,注意溶液组成的表示方法,注意公式的灵活应用,题目难度中等.

练习册系列答案
相关题目
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数( )
| A、42% | B、58% |
| C、36% | D、64% |
下列图象表达正确的是( )


| A、图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1mol/L氨水 |
| B、图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 |
| C、图③表示向CaCl2溶液中通入CO2 |
| D、图④表示向醋酸溶液中滴入氨水 |
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示.在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A、 |
B、 |
C、 |
D、 |
在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是( )
| A、烧杯中有铜无铁 |
| B、烧杯中有铁无铜 |
| C、烧杯中铁铜都有 |
| D、烧杯中铁铜都无 |
在室温下,下列叙述正确的是( )
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
 氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下: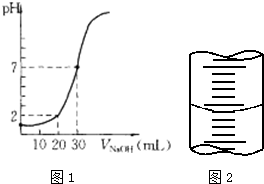 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题: