题目内容
10.雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).(1)若在一定温度下,将1.0molNO、0.5molCO充入0.5L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8mol、0.3mol、0.2mol、0.1mol,该反应的化学平衡常数K=$\frac{5}{144}$或0.0347;若保持温度不变,再向容器中充入CO、N2各0.3mol,平衡将不移动(填“向左”、“向右”或“不”).
(2)CO可以合成甲醇.已知:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1;
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1;
则CO(g)+2H2(g)?CH3OH(g)△H=-90kJ•mol-1.
分析 (1)根据三行式来求平衡时各组分的浓度,然后代入表达式求解;求此时的浓度商与平衡常数的大小关系来判断移动方向;
(2)根据盖斯定律$\frac{1}{2}$②+③-$\frac{1}{2}$①可得目标反应CO(g)+2H2(g)?CH3OH(g),据此计算出该反应的△H.
解答 解:(1)反应2NO+2CO?2CO2 +N2达到平衡时各组分的浓度分别为:c(NO)$\frac{0.8mol}{0.5L}$=1.6mol/L,c(CO)=$\frac{0.3mol}{0.5L}$=0.6mol/L,c(CO2)=$\frac{0.2mol}{0.5L}$0.4mol/L,c(N2)=$\frac{0.1mol}{0.5L}$=0.2mol/L,则该反应的平衡常数为:K=$\frac{0.{4}^{2}×0.2}{1.{6}^{2}×0.{6}^{2}}$=$\frac{5}{144}$≈0.0347;
再向容器中充入CO、N2各0.3mol,此时的浓度商Qc=$\frac{0.{4}^{2}×0.8}{1.{6}^{2}×1.{2}^{2}}$=0.0347=K,所以平衡不移动,
故答案为:$\frac{5}{144}$或0.0347;不;
(2)①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1;
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1;
根据盖斯定律,$\frac{1}{2}$②+③-$\frac{1}{2}$①可得:CO(g)+2H2(g)?CH3OH(g)△H=$\frac{1}{2}$×(-566.0kJ•mol-1)+(-571.6kJ•mol-1)-$\frac{1}{2}$(-1529kJ•mol-1)=-90.1kJ•mol-1,
故答案为:-90.1.
点评 本题考查了化学平衡常数的计算、盖斯定律的应用等知识,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 单质碘 | B. | 硫化氢 | C. | 氯化镁 | D. | 氢氧化钠 |
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
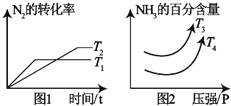
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)
| A. | 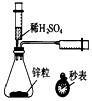 测定一定时间内生成H2的反应速率 | B. | 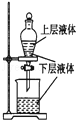 提取海带中的碘 | ||
| C. | 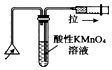 检验火柴燃烧产生的SO2 | D. | 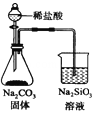 证明非金属性:Cl>C>Si |

 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: