题目内容
15.下列状态的物质,既能导电又属于电解质的是( )| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
分析 能导电的物质必须含有自由电子或自由移动的离子;电解质是指:在水溶液中或熔融状态下能够导电的化合物;电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;单质、混合物,不是电解质,据此分析即可解答.
解答 解:A.盐酸能电离出自由移动的氢离子和氯离子,故盐酸能导电,它是由氯化氢和水组成的混合物,所以它既不是电解质也不是非电解质,故A错误;
B.NH3没有自由移动的离子,故不导电;虽然在水溶液中能够电离出自由移动的离子,能导电,但不是本身电离,所以是非电解质,故B错误;
C.熔融的Al2O3,因熔融有自由移动的铝离子和氧离子,能导电,Al2O3是化合物,是电解质,故C正确;
D.BaSO4晶体没有自由移动的离子,故不导电;在熔融状态下能够电离出自由移动的钡离子和硫酸根离子,能导电,是电解质,故D错误;
故选:C.
点评 本题考查了导电的物质和电解质概念的判断,抓住“能导电的物质必须含有自由电子或自由移动的离子;电解质是化合物在水溶液中或熔融状态下,能电离”,题目难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
5.用于制造隐形飞机的某种物质结构为: 则该物质属于( )
则该物质属于( )
 则该物质属于( )
则该物质属于( )| A. | 烯烃 | B. | 无机物 | C. | 有机物 | D. | 烷烃 |
6.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )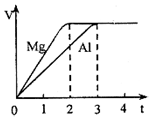

| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
10.下列粒子与NH4+的质子总数和电子总数相同的是( )
| A. | F- | B. | Ne | C. | H3O+ | D. | NH2- |
20.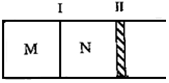 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
