题目内容
12.根据下列反应写出相应的化学方程式.(1)稀盐酸与CaCO3反应:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)制作Fe(OH)3胶体:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
分析 (1)稀盐酸与CaCO3反应生成氯化钙、二氧化碳和水;
(2)在加热条件下,FeCl3水解生成氢氧化铁和HCl.
解答 解:(1)稀盐酸与CaCO3反应生成氯化钙、二氧化碳和水,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)在加热条件下,FeCl3水解生成氢氧化铁和HCl,反应的方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
点评 本题考查水解方程式和化学方程式书写、胶体的制备,掌握相关的反应原理是解答的关键,题目难度不大.

练习册系列答案
相关题目
7.常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )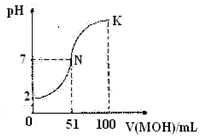

| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
17.(1)工业废水中含有重金属离子Cu2+,需要将其转化沉淀除去,请选择合适沉淀剂Na2S、K2S溶液.己知常温下:
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
②能否控制pH将三种离子逐一分离出溶液通过调PH为3.2~4.7,可以先将铁离子沉淀分离出溶液,如果将PH调至6.7,可以将铜离子完全沉淀分离出去,但同时大部分亚铁离子也沉淀了,即铜离子和亚铁离子无法分离,.
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
4.加入HCl溶液后,溶液中离子数目会减少的是( )
| A. | CO32- | B. | Al3+ | C. | SO42- | D. | NO3- |
1.下列有关化学科学的说法中正确的是( )
| A. | 我们的祖先很早就学会了烧制陶瓷、冶炼金属、酿造酒类 | |
| B. | 化学研究的主要目的是认识分子 | |
| C. | 化学科学无法帮助研究人员了解疾病的病理 | |
| D. | 意大利化学家阿伏伽德罗提出了原子学说,为近代化学的发展奠定了基础 |