题目内容
9.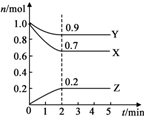 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.(1)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为v(X)=0.075mol•(L•min)-1.
(2)由图中所给数据进行分析,该反应的化学方程式为3X+Y?2Z;
(3)达到平衡时Y的转化率是10%,增大压强,X的转化率增大(填“增大””减小”或”不变”)
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)转化率=$\frac{消耗量}{起始量}$×100%;增大压强,平衡正向移动.
解答 解:(1)v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol•(L•min)-1,故答案为:0.075mol•(L•min)-1;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,故答案为:3X+Y?2Z;
(3)反应达平衡时Y的转化率=$\frac{1.0mol-0.9mol}{1.0mol}$×100%=10%,增大压强,平衡正向移动,X的转化率增大,故答案为:10%;增大.
点评 本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.美国科学家找到了一种突破目前锂离子电池充电量和充电速度限制的方法,该方法将硅簇置入石墨烯层之间,达到提升电池内部锂离子密度的效果,这种材料制成的新型锂电池充电容量和效率都比普通锂电池提高近十倍,下列有关说法正确的是( )
| A. | 电池工作时,锂电极为阳极,发生还原反应 | |
| B. | 电池充电时,Li+向阴极移动 | |
| C. | 该电池的化学能可完全转化为电能 | |
| D. | 新材料就是碳和硅化合而成的碳化硅材料 |
17.完成下列表格内容
| 实验操作 | 现象 | 离子方程式 |
| 向澄清石灰水中通入少量CO2气体 | ||
| 向硫酸溶液中投入少量Mg粉 | ||
| 向醋酸溶液中滴加NaOH溶液 | 无明显现象 |
4.在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
14.同温同压下,分子数相同的氨气和氢气,它们( )
| A. | 所占的体积相同 | B. | 密度相同 | ||
| C. | 所含原子数目相同 | D. | 所占体积一定是22.4L |
1.某溶液中有Cu2+、SO42-、Cl-、NO3-四种离子,若向溶液中加入足量的Ba(OH)2溶液,溶液中能大量减少的离子是( )
①Cu2+ ②SO42- ③Cl- ④NO3-.
①Cu2+ ②SO42- ③Cl- ④NO3-.
| A. | ① | B. | ② | C. | ①② | D. | ③④ |
1.把a L含硫酸铵的硝酸铵的混合液分成两等份.一份加入b mol NaOH并加热,恰好把NH3全部赶走;另一份消耗c molBaCl2时,SO${\;}_{4}^{2-}$恰好沉淀完全,则原溶液中NO${\;}_{3}^{-}$的浓度为( )
| A. | $\frac{b-2c}{a}$ mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{4c-2b}{a}$ mol/L | D. | $\frac{b-4c}{a}$mol/L |
 如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图
如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图