题目内容
18.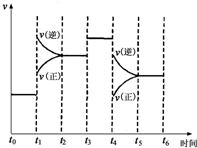 如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图
如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图(1)下列时间段中,氨的百分含量最高的是A.
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(2)t1时刻改变的条件是升高温度;t3时刻改变的条件是使用催化剂;t4时刻改变的条件是减小压强.
分析 (1)可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,该反应为体积减小的放热反应,改变反应条件平衡移动,根据各时刻的速率变化判断平衡移动移动方向,据此判断NH3的含量变化;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3正逆反应速率同等程度的增大;t4时正逆反应速率均减小,且逆反应速率大于正反应速率.
解答 解:可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,该反应为体积减小的放热反应.
(1)可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,该反应为体积减小的放热反应,
t0~t1,正、逆反应速率相等,平衡不移动;
t1~t2,正、逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致氨气的含量降低,氨气含量较t0~t1低;
t2~t3,正、逆反应速率相等,处于平衡状态,氨气的含量不变,氨气含量较t1~t2低;
t3~t4,正、逆反应速率都同等程度的增大平衡不移动,氨气的含量不变,氨气含量与t2~t3相同;
t4~t5,正、逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,氨气的含量降低;
t5~t6,正、逆反应速率相等,平衡不移动,氨气的含量不变,氨气含量较t4~t5低;
所以平衡混合物中氨的百分含量最低的时间段是t5~t6,NH3的含量最高的一段时间是t0~t1,
故答案为:A;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,该反应正反应为放热反应,所以改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:升高温度;使用催化剂;减小压强.
点评 本题考查化学反应速率的变化曲线,题目难度中等,注意化学方程式的特点,判断温度、压强对反应平衡移动的影响,结合外界条件对反应速率的影响分析.

| A. | 有碱性 | B. | 有强氧化性 | C. | 有强还原性 | D. | 很难被还原 |
| A. | NH3具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | 氨水的主要成分是NH3 |
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
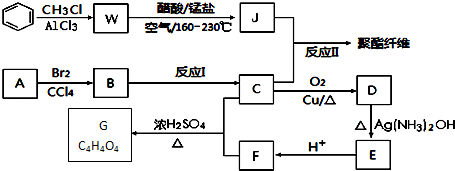
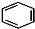 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$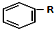 +HCl(-R为烃基)
+HCl(-R为烃基)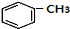 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$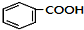
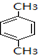 .
. .
.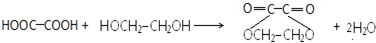 .
.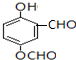 (写出一种即可);
(写出一种即可);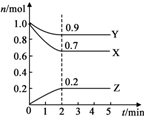 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.