题目内容
19.实验室需要240mL、0.2mol•L-1的稀硫酸,现用溶质质量分数为98%、密度为1.84 g•cm-3的浓硫酸来配制.可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥容量瓶;⑦托盘天平;⑧药匙.请完成下列问题:(1)上述仪器中,在配制稀硫酸时用不到的有②⑦⑧(填代号),
需要的容量瓶规格为250 毫升.
(2)经计算,浓硫酸物质的量浓度为18.4mol/L,需浓硫酸的体积为2.7.现有①5 mL ②10 mL ③20 mL三种规格的量筒,你选用的量筒是① (填序号)
(3)在配制过程中,能引起误差偏高的有①②⑥(填代号).
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③定容时,加蒸馏水超过标线,又用胶头滴管吸出
④转移前,容量瓶中含有少量蒸馏水
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑥定容时,俯视标线.
分析 (1)依据用浓溶液配制一定物质的量浓度溶液的一般步骤选择需要仪器,依据配制溶液体积选择容量瓶规格;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;溶液稀释过程中所含溶质的物质的量保持不变,据此计算需要浓硫酸的体积,据此选择量筒规格;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,用不到的仪器:烧瓶、托盘天平、药匙;
需要240mL、0.2mol•L-1的稀硫酸,实验室没有240mL容量瓶,应选择250mL容量瓶;
故答案为:②⑦⑧;250;
(2)98%的浓硫酸(其密度为1.84 g/cm3)物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则V×18.4mol/L=0.2mol/L×250mL,解得V=2.7mL;应选择5mL量筒;
故答案为:18.4mol/L;2.7;①;
(3)①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故选;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
③定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,故不选;
⑥定容时,俯视标线,导致溶液体积偏小,溶液浓度偏高,故选;
故选:①②⑥.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶、量筒规格的选择及使用方法和误差分析的方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| B. | MgCO3与NaOH溶液反应生成沉淀:MgCO3+2OH-═Mg(OH)2↓+CO32- | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向NH4HSO4溶液中滴加过量NaOH溶液:NH4++HSO4-+2OH-═SO42-+NH3•H2O |
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用水洗净后,在干燥箱中 干燥 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 | |
| D. | 定容后,盖好瓶塞,用食指顶住瓶塞,手握住瓶进颈,左右振荡摇匀 |
 25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-6 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)═c(Y-)+c(Z-)+c(OH-) |
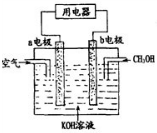 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.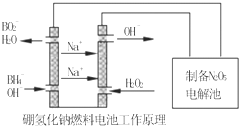 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下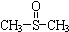 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下: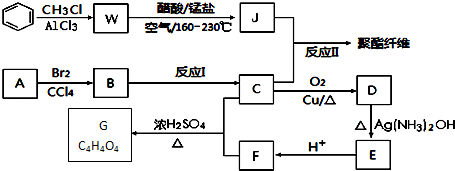
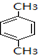
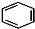 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$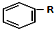 +HCl(-R为烃基)
+HCl(-R为烃基)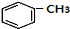 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$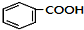
 .
. .
.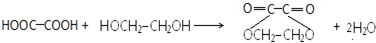 .
.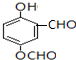 (写出一种即可);
(写出一种即可);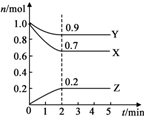 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.