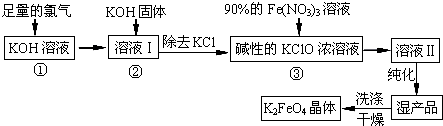
题目内容
1.把a L含硫酸铵的硝酸铵的混合液分成两等份.一份加入b mol NaOH并加热,恰好把NH3全部赶走;另一份消耗c molBaCl2时,SO${\;}_{4}^{2-}$恰好沉淀完全,则原溶液中NO${\;}_{3}^{-}$的浓度为( )| A. | $\frac{b-2c}{a}$ mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{4c-2b}{a}$ mol/L | D. | $\frac{b-4c}{a}$mol/L |
分析 bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol,
令每份中NO3-的物质的量为n,根据溶液不显电性,
则:bmol×1=cmol×2+n×1,
解得:n=(b-2c)mol,
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=$\frac{(b-2c)mol}{0.5aL}$=$\frac{2b-4c}{a}$mol/L,
即原溶液中硝酸根的浓度为$\frac{2b-4c}{a}$mol/L,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.某种不饱和烃分子中含有一个C≡C键、一个C═C键,催化加氢后的结构简式如下:(CH3CH2)2CHCH2CH(CH3)CH(CH3)2,则该烃的结构最多有( )
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
9.有一固体混合物,可能含有FeCl2?NaNO2?Ba(OH)2?AlCl3?Na2SO3中的若干种?取适量该混合物,加足量水充分搅拌,得到白色沉淀E与无色溶液G.继续进行以下实验:
①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
16.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:
根据上述实验,下列说法正确的是( )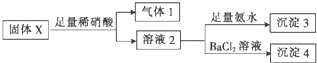
根据上述实验,下列说法正确的是( )

| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
10.在10-9m~10-7m范围内,对原子、分子进行进行操纵的纳米超分子技术往往能实现意想不到的变化.纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸.下列说法正确的是( )
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
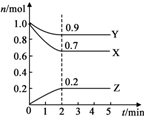 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.