题目内容
17.完成下列表格内容| 实验操作 | 现象 | 离子方程式 |
| 向澄清石灰水中通入少量CO2气体 | ||
| 向硫酸溶液中投入少量Mg粉 | ||
| 向醋酸溶液中滴加NaOH溶液 | 无明显现象 |
分析 石灰水与少量二氧化碳反应生成碳酸钙和水;
Mg与硫酸反应生成硫酸镁和氢气;
醋酸与NaOH发生中和反应生成醋酸钠和水.
解答 解:CO2为氧化物,不能拆,而澄清石灰水需要全部拆为离子,反应的离子方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,观察到溶液变浑浊;
向硫酸溶液中投入少量Mg粉的离子反应为Mg+2H+=Mg2++H2↑,观察到有气泡冒出;
向醋酸溶液中滴加NaOH溶液,发生CH3COOH+OH-=CH3COO-+H2O,无明显现象,
故答案为:
| 实验操作 | 现象 | 离子方程式 |
| 向澄清石灰水中通入少量CO2气体 | 溶液变浑浊 | Ca2++2OH-+CO2=CaCO3↓+H2O |
| 向硫酸溶液中投入少量Mg粉 | 有气泡冒出 | Mg+2H+=Mg2++H2↑ |
| 向醋酸溶液中滴加NaOH溶液 | 无明显现象 | CH3COOH+OH-=CH3COO-+H2O |
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列有关说法正确的是( )
| A. | 分子晶体中共价键越强,熔沸点越高 | |
| B. | 只含共价键的物质,一定是共价化合物 | |
| C. | HF的分子间作用力大于HCl,故HF比HCl更稳定 | |
| D. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
12.下列物质所属类别正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
6.下列有关Na+离子的叙述中正确的是( )
| A. | 有碱性 | B. | 有强氧化性 | C. | 有强还原性 | D. | 很难被还原 |
9.有一固体混合物,可能含有FeCl2?NaNO2?Ba(OH)2?AlCl3?Na2SO3中的若干种?取适量该混合物,加足量水充分搅拌,得到白色沉淀E与无色溶液G.继续进行以下实验:
①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
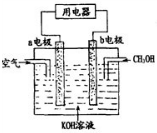 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
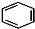 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$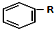 +HCl(-R为烃基)
+HCl(-R为烃基)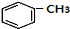 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$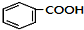
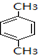 .
. .
.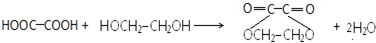 .
.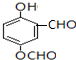 (写出一种即可);
(写出一种即可);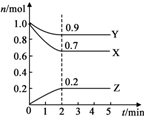 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.