题目内容
15.一学习小组用100g某硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4•7H2O),主要流程如图: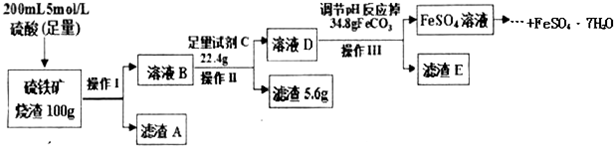
请回答下列问题:
(1)硫铁矿烧渣中加入硫酸酸浸往往需要升温,目的是提高浸取效率,操作1的名称是过滤,滤渣A是SiO2.
(2)试剂C为铁粉,加入该试剂的目的是2Fe3++Fe=3Fe2+ (用离子方程式表示).
(3)调节溶液D的pH目的是使Al3+转化为Al(OH)3沉淀.
(4)己知常温下Al(OH)3的Ksp=l.0×10-33,若溶液中c(Al3+)为1.0mol/L,请计算Al3+开始沉淀的pH=3.
(5)依据上述流程中的相关数据,求该硫铁矿烧渣中Fe2O3的质量分数为48%.
(本实验各操作中损失的硫酸盐、硫酸及调pH后溶液呈微酸性残留的硫酸忽略不计)
分析 硫铁矿烧渣用足量的硫酸浸取,Fe2O3、Al2O3会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,而SiO2不反应,过滤把SiO2除去,然后再向滤液中加入足量的铁粉,将Fe3+转化成Fe2+,加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去,得到FeSO4溶液,再经过加热浓缩、冷却结晶、过滤、洗涤得到FeSO4•7H2O.
(1)升高温度,反应速率加快;操作1是分离互不相溶的固体与液态;滤渣A是二氧化硅;
(2)试剂C是铁粉,加入足量的铁粉将Fe3+转化成Fe2+;
(3)加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去;
(4)Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=1.0×10-33计算开始沉淀时c(OH-),再根据水的离子积计算溶液中c(H+),根据pH=-lgc(H+)计算;
(5)操作Ⅱ消耗Fe的质量为22.4g-5.6g=16.8g,根据2Fe3++Fe=3Fe2+计算n(Fe3+),可得氧化铁的物质的量,进而计算Fe2O3的质量分数.
解答 解:硫铁矿烧渣用足量的硫酸浸取,Fe2O3、Al2O3会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,而SiO2不反应,过滤把SiO2除去,然后再向滤液中加入足量的铁粉,将Fe3+转化成Fe2+,加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去,得到FeSO4溶液,再经过加热浓缩、冷却结晶、过滤、洗涤得到FeSO4•7H2O.
(1)升高温度,反应速率加快,可以提高浸取效率;操作1是分离互不相溶的固体与液态,采取过滤操作;滤渣A是SiO2,
故答案为:提高浸取效率;过滤;SiO2;
(2)试剂C是铁粉,加入足量的铁粉将Fe3+转化成Fe2+,反应离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:铁粉;2Fe3++Fe=3Fe2+;
(3)加入碳酸亚铁调节溶液的pH,使Al3+转化为Al(OH)3沉淀过滤除去,
故答案为:使Al3+转化为Al(OH)3沉淀;
(4)溶液中c(Al3+)=1.0mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=1.0×10-33,可知开始沉淀时c(OH-)=1×10-11mol/L,则溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=1×10-3,此时溶液pH=-lgc(H+)=1×10-3=3,
故答案为:3;
(5)操作Ⅱ消耗Fe的质量为22.4g-5.6g=16.8g,其物质的量为$\frac{16.8g}{56g/mol}$=0.3mol,根据2Fe3++Fe=3Fe2+可知n(Fe3+)=2×0.3mol=0.6mol,故氧化铁的物质的量为$\frac{0.6mol}{2}$=0.3mol,Fe2O3的质量分数为$\frac{0.3mol×160g/mol}{100g}$=48%,
故答案为:48%.
点评 本题属于物质制备工艺流程题目,涉及物质的分离提纯、对操作与原理的分析评价、溶度积有关计算、物质含量计算等,关键是理解工艺流程中各操作原理,熟练掌握元素化合物知识,难度中等.

| A. | N2O5→HNO3 | B. | Cl-→ClO3- | C. | MnO2→Mn2+ | D. | H2→H2O |
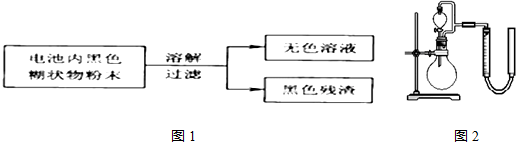
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |

| A. | x=2 | B. | y=3 | ||
| C. | z=4 | D. | 图(d)的化学式为BO2 |
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
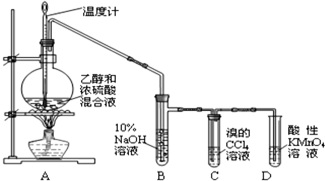
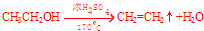 .
.