题目内容
10.如图所示,装置Ⅰ为乙烯(C2H4)燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
①a处应通入C2H4(填“C2H4”或“O2”),a处电极上发生的电极反应式是C2H4+16OH--12e-═2CO32-+10H2O;
②电镀结束后,装置Ⅰ中KOH溶液的浓度变小(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度不变;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有CO32-;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗乙烯0.75L(标准状况下).
分析 ①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;C2H4失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③I中还有碳酸根离子生成;
④根据转移电子相等计算消耗甲烷的体积.
解答 解:①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是C2H4;C2H4失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为C2H4+16OH--12e-═2CO32-+10H2O,
故答案为:C2H4;C2H4+16OH--12e-═2CO32-+10H2O;
②根据I中电池反应为C2H4+3O2+4KOH=2K2CO3+4H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③I中负极反应为C2H4+16OH--12e-═2CO32-+10H2O,所以还有碳酸根离子生成,故答案为:CO32-;
④装置Ⅱ中阴极质量变化12.8g,则转移电子为$\frac{12.8g}{64g/mol}$×2=0.4mol,串联电路中转移电子相等,所以消耗乙烯的体积=$\frac{1}{12}$×0.4mol×22.4L/mol≈0.75L,
故答案为:0.75.
点评 本题考查了原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.如果家里的食用菜籽油混有少量水份,你将采用下列何种方法分离( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
1.下列关于普通玻璃的叙述中,正确的是( )
| A. | 玻璃是人类是早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅 |
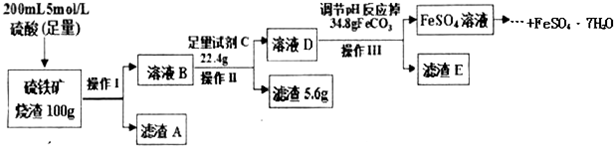
5.工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
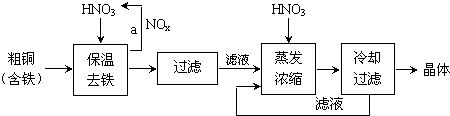
①在步骤a中,还需要通入氧气和水,其目的是提高原料的利用率,减少污染物的排放.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7 范围.

①在步骤a中,还需要通入氧气和水,其目的是提高原料的利用率,减少污染物的排放.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7 范围.
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
11.将15g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加9g,则原溶液中硝酸的浓度为( )
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |