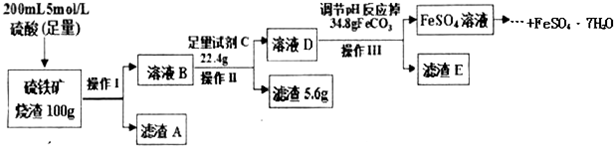
题目内容
5.下列变化需要加入还原剂的是( )| A. | N2O5→HNO3 | B. | Cl-→ClO3- | C. | MnO2→Mn2+ | D. | H2→H2O |
分析 需要加入还原剂,则选项中为氧化剂的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.N元素的化合价不变,不发生氧化还原反应,故A不选;
B.Cl元素的化合价升高,需要加氧化剂,故B不选;
C.Mn元素的化合价降低,需要加还原剂,故C选;
D.H元素的化合价升高,需要加氧化剂,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意结合化合价分析,题目难度不大.

练习册系列答案
相关题目
15.下列对有关“物质的量与摩尔(mol)”的叙述正确的是( )
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
16.下列分散系中,分散质微粒半径最小的是( )
| A. | 雾 | B. | 蛋白质溶液 | C. | NaCl溶液 | D. | 新制Cu(OH)2悬浊液 |
13.阿伏加德罗常数约为6.02×1023 mol-1(NA),下列说法正确的是( )
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
20.如果家里的食用菜籽油混有少量水份,你将采用下列何种方法分离( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
10.NH3可消除NO的污染,反应化学方程式为6NO+4NH3=5N2+6H2O.现有NH3和NO的混合物1mol 充分反应,若还原产物比氧化产物多1.4g.则下列判断正确的是( )
| A. | 生成N2为5.6L | |
| B. | 有0.3mol NO 被还原 | |
| C. | 生成氧化产物4.2g | |
| D. | 原混合物中NO 和NH3的物质的量之比可能为3:22 |
17.下列物质不属于有机物的是( )
| A. |  | B. | CO(NH2)2 | C. | CCl4 | D. |  |
14.下列说法正确的是( )
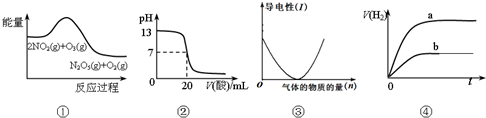

| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入醋酸体积的变化 | |
| C. | ③可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |