题目内容
16.在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)(1)如何用实验证明淀粉未通过半透膜.
(2)要求只检验一种离子,就能证明钠离子、氯离子通过半透膜,写出检验该离子的实验方法.
(3)如何用实验证明两者已完全分离.
分析 (1)碘遇淀粉变蓝色;
(2)因为Cl-的半径大于Na+,因此只要检验Cl-即可说明;
(3)通过检验氯离子证明完全分离.
解答 解:(1)碘遇淀粉变蓝色,向其中滴加碘水,发现不变蓝色,说明淀粉未通过半透膜,故答案为:取烧杯中少量液体,向其中滴加碘水,发现不变蓝色,说明淀粉未通过半透膜;
(2)因为Cl-的半径大于Na+,因此只要检验Cl-即可说明,滴加硝酸酸化的硝酸银溶液,有白色沉淀,证明Na+、Cl-透过半透膜,故答案为:因为Cl-的半径大于Na+,因此只要检验Cl-即可说明;取烧杯中少量液体,向其中滴加硝酸酸化的硝酸银溶液,有白色沉淀,证明Na+、Cl-透过半透膜;
(3)通过检验氯离子证明完全分离,向其中滴加酸化的AgNO3溶液,若无沉淀产生,则说明两者已完全分离,故答案为:经过多次更换烧杯中的水,最终取烧杯中少量液体,向其中滴加酸化的AgNO3溶液,若无沉淀产生,则说明两者已完全分离.
点评 本题考查胶体的性质、实验方案设计,难度较小,注意基础知识的积累掌握.

练习册系列答案
相关题目
7.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
4.一定质量的混合气体在密闭容器中发生如下反应:xA(气)+yB(气)?zC(气).达到平衡后,测得A气体的浓度为0.5mol/L.当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L.下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |
11.将15g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加9g,则原溶液中硝酸的浓度为( )
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 500 mL1 mol/L MgCl2溶液中含有Cl-数目为0.5NA | |
| B. | 标准状况下,33.6L SO3与48gO2所占的体积相等 | |
| C. | 17 gNH3含有的电子个数为l0NA | |
| D. | 1 mol O2与2 mol SO2一定条件下混合反应,可生成2 mol SO3 |
6.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
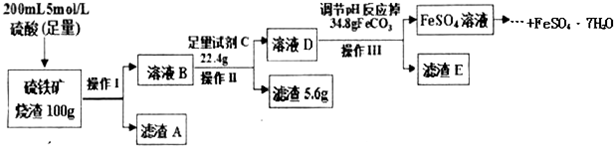
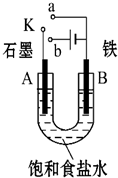 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.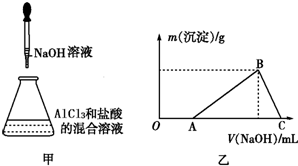 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.