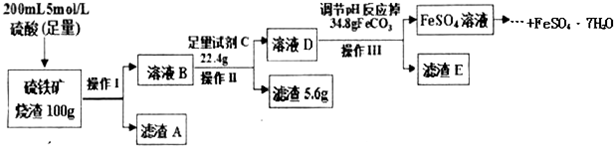
题目内容
3.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.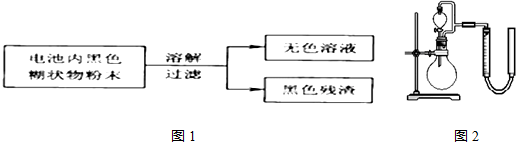
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
分析 (1)锌锰干电池的负极上Zn失去电子,负极消耗1mol时转移2mol电子,NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气;
(2)Zn(OH)2是两性氢氧化物,能溶解在NaOH溶液中,无色溶液中含Zn2+、NH4+,加碱均发生反应;
(3)等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一、二中参加反应的H2O2的物质的量相同;实验二中反应生成锰离子、水、氧气.
解答 解:(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,负极消耗1mol时转移2mol电子,每通过0.2mole-,负极质量减少0.1mol×65g/mol=6.5g,由NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,正极反应为2NH4++2e-═2NH3↑+H2↑,
故答案为:6.5;2NH4++2e-═2NH3↑+H2↑;
(2)①无色溶液中含Zn2+、NH4+,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 白色沉淀逐渐溶解,产生刺激性气味的气体 | 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
(3)等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一中过氧化氢既是氧化剂又是还原剂,实验二中H2O2是还原剂,由氧气的体积1:2可知,等物质的量的过氧化氢均完全反应,则参加反应的H2O2的物质的量之比为1:1,实验二中反应生成锰离子、水、氧气,离子反应为H2O2+2H++MnO2═Mn2++2H2O+O2↑;
故答案为:1:1;H2O2+2H++MnO2═Mn2++2H2O+O2↑.
点评 本题考查较为综合,涉及原电池、离子反应、氧化还原反应及实验设计,明确习题中的信息及物质的性质即可解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.阿伏加德罗常数约为6.02×1023 mol-1(NA),下列说法正确的是( )
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
14.下列说法正确的是( )
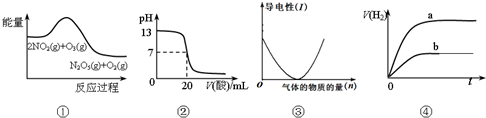

| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入醋酸体积的变化 | |
| C. | ③可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
11.乙烯和苯是两种基本化工原料,下列有关说法正确的是( )
| A. | 乙烯和苯都可以从煤焦油中获得 | |
| B. | 乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 | |
| C. | 乙烯和苯都能使溴水褪色,且褪色的原因相同 | |
| D. | 乙烯和苯都能与H2发生加成反应 |
8.一定条件下,将1mol A和3mol B充入恒容密闭容器中,发生如下反应:A(g)+3B(g)?2C(s),下列不能说明该反应已经达到平衡状态的是( )
| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
12.丙烯酸的结构简式为CH2=CH-COOH,下列关于丙烯酸的说法错误的是( )
| A. | 丙烯酸可以发生取代反应 | |
| B. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯酸与HBr发生加成反应只能得到唯一产物 | |
| D. | 丙烯酸钠溶液中Na+浓度大于丙烯酸根离子浓度 |
4.一定质量的混合气体在密闭容器中发生如下反应:xA(气)+yB(气)?zC(气).达到平衡后,测得A气体的浓度为0.5mol/L.当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L.下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |