题目内容
下列各项叙述中,说法不正确的是( )
| A、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| B、镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 |
| C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 |
| D、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
考点:原子核外电子的运动状态,原子核外电子排布
专题:原子组成与结构专题
分析:A.根据s电子云轮廓图都是球形,但能层越大,球的半径越大;
B.根据原子由基态转化成激发态,电子能量增大,需要吸收能量;
C.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
D.根据主族元素的周期序数=电子层数;最外层电子=主族序数;最后一个电子排在哪个轨道就属于哪个区;
B.根据原子由基态转化成激发态,电子能量增大,需要吸收能量;
C.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
D.根据主族元素的周期序数=电子层数;最外层电子=主族序数;最后一个电子排在哪个轨道就属于哪个区;
解答:
解:A.所有原子任一能层的S电子云轮廓图都是球形,能层越大,球的半径越大,故A正确;
B.基态Mg的电子排布式为1s22s22p63s2,能量处于最低状态,当变为1s22s22p63p2时,电子发生跃迁,需要吸收能量,变为激发态,故B正确;
C.同一周期元素的第一电离能随着原子序数的增大而增大,所以最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大,故C正确;
D.价电子排布为5s25p1的元素最外层电子数为3,电子层数是5,最后一个电子排在P轨道,所以该元素位于第五周期第ⅢA族,是P区元素,故D错误;
故选D;
B.基态Mg的电子排布式为1s22s22p63s2,能量处于最低状态,当变为1s22s22p63p2时,电子发生跃迁,需要吸收能量,变为激发态,故B正确;
C.同一周期元素的第一电离能随着原子序数的增大而增大,所以最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大,故C正确;
D.价电子排布为5s25p1的元素最外层电子数为3,电子层数是5,最后一个电子排在P轨道,所以该元素位于第五周期第ⅢA族,是P区元素,故D错误;
故选D;
点评:本题主要考查了电子排布式的运用、轨道形状以及电离能,难度不大,根据所学知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
不影响H2O的电离平衡的粒子是( )
A、 | ||
B、
| ||
C、 | ||
D、 - - |
下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
| A、增大浓度 | B、增大压强 |
| C、升高温度 | D、使用催化剂 |
下列各项比较中正确的是( )
| A、微粒半径:Na+>S2->O2- |
| B、结合质子的能力:ClO->CH3COO->HCO3- |
| C、固体的热稳定性:Na2CO3>CaCO3>NaHCO3 |
| D、碱性:NaOH>KOH>Mg(OH)2 |
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成1molCl2转移的电子为2NA |
| B、1molC8H18分子中含有的共用电子对数为26NA |
| C、在0℃,101kPa,1molSO3中含有NA个硫原子 |
| D、0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA |
只有阳离子而没有阴离子的晶体是( )
| A、金属晶体 | B、原子晶体 |
| C、离子晶体 | D、分子晶体 |
下列说法一定正确的是( )
| A、元素的性质呈周期性变化的根本原因是第一电离能呈周期性变化 |
| B、3p能级上只有一个空轨道的原子所对应的元素和3p能级上有一个未成对电子的原子所对应的元素属于同一周期 |
| C、电子层数少的元素的原子半径小于电子层数多的元素的原子半径 |
| D、键长短的共价键的键能大于键长长的共价键的键能 |
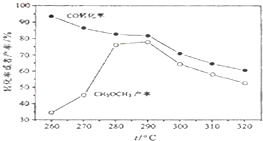 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图: