题目内容
写出列电解质在水溶液中的电离方程式:
(1)醋酸 ;
(2)氨水 ;
(3)硫酸 .
(1)醋酸
(2)氨水
(3)硫酸
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子;
(2)一水合氨是弱碱,不能完全电离,部分电离出铵根离子与氢氧根离子;
(3)硫酸为强电解质,电离生成氢离子和硫酸根离子;
(2)一水合氨是弱碱,不能完全电离,部分电离出铵根离子与氢氧根离子;
(3)硫酸为强电解质,电离生成氢离子和硫酸根离子;
解答:
解:(1)醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
(2)一水合氨在溶液中电离出铵根离子和氢氧根离子,其电离方程式为:NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-,
故答案为:H2SO4=2H++SO42-;
故答案为:CH3COOH?H++CH3COO-;
(2)一水合氨在溶液中电离出铵根离子和氢氧根离子,其电离方程式为:NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-;
(3)硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-,
故答案为:H2SO4=2H++SO42-;
点评:本题考查了电离方程式的书写,题目难度不大,注意书写方法是解答本题的关键.注意电荷守恒和质量守恒定律、原子团、弱酸的酸根离子符号等.注意强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”.

练习册系列答案
相关题目
一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO
.现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是( )
2- 4 |
| A、被还原的硝酸为0.08mol |
| B、反应后溶液中仍有硝酸剩余 |
| C、反应后溶液的pH=1 |
| D、CuS未全部参加反应 |
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
| A、都呈透明的红褐色 |
| B、分散质颗粒直径相同 |
| C、都比较稳定,密封保存一段时间都不会产生沉淀 |
| D、都能产生丁达尔现象 |
下列各项叙述中,说法不正确的是( )
| A、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| B、镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 |
| C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 |
| D、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
下列各组离于在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+ Ba2+ Cl- SO42- |
| B、K+ Na+ NO3- OH- |
| C、H+ NH4+ Fe3+ SO42- |
| D、H+ Cl- CO32- NO3- |
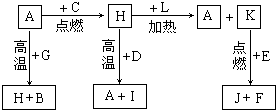 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示: