题目内容
只有阳离子而没有阴离子的晶体是( )
| A、金属晶体 | B、原子晶体 |
| C、离子晶体 | D、分子晶体 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:根据晶体中构成微粒来分析,金属晶体由金属阳离子和自由电子构成;原子晶体由原子构成;离子键由离子构成;分子晶体由分子构成.
解答:
解:A、金属晶体是由金属阳离子和自由电子构成的,故A正确;
B、原子晶体是原子间通过共价键结合形成的空间网状的晶体,故B错误;
C、离子晶体是阴阳离子间通过离子键结合形成的晶体,故C错误;
D、分子晶体是分子间通过分子间作用力结合形成的晶体,故D错误;
故选A.
B、原子晶体是原子间通过共价键结合形成的空间网状的晶体,故B错误;
C、离子晶体是阴阳离子间通过离子键结合形成的晶体,故C错误;
D、分子晶体是分子间通过分子间作用力结合形成的晶体,故D错误;
故选A.
点评:本题考查了晶体中构成微粒的判断,题目难度不大,注意掌握常见晶体的构成微粒.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各项叙述中,说法不正确的是( )
| A、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| B、镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 |
| C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 |
| D、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
下列离子方程式书写正确的是( )
| A、在Fe(OH)3胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| B、在稀氨水中通入少量SO2:NH3?H2O+SO2=NH4++HSO3- |
| C、向澄清石灰水中加入足量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、在酸性KMnO4溶液中加入H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
在等体积的ZnCl2、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
| A、1:2:3 |
| B、2:2:3 |
| C、1:1:1 |
| D、3:3:2 |
下列有关金属的叙述中正确的是( )
| A、金属元素的原子只有还原性,离子只有氧化性 |
| B、金属元素在化合物中一定显正价 |
| C、金属元素在不同的化合物中的化合价均相同 |
| D、酸根离子中一定不含金属原子 |
下列各组离于在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+ Ba2+ Cl- SO42- |
| B、K+ Na+ NO3- OH- |
| C、H+ NH4+ Fe3+ SO42- |
| D、H+ Cl- CO32- NO3- |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1mol?L-1Na2CO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、向0.2 mol?L-1NaHCO3溶液中加入等体积0.1mol?L-1NaOH溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+) |
| D、在25℃时,1 mol?L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH) |
下列溶液中各微粒的浓度关系正确的是( )
| A、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
| C、1.0mol/L Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
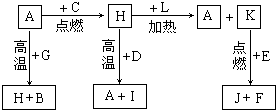 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示: