题目内容
3.辉铜矿的主要成分是Cu2S,可用于制取金属铜和铜盐.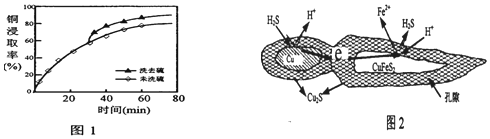
(1)己知部分反应的热化学方程式如下:
C(s)+S2(g)═CS2(g)△H1=akJ•mol-1
Cu2S(s)+H2(g)═2Cu(s)+H2S(g)△H2=bkJ•mol-1
2H2S(g)═2H2(g)+S2(g)△H3=ckJ•mol-1
则C(s)+2Cu2S(s)═4Cu(s)+CS2(g)的△H=a+2b+ckJ•mol-1(用含 a、b、c 的代数式表示).
(2)从辉铜矿中浸取铜元素,可用FeC3作浸取剂.
①反应Cu2S+4FeCl3═2CuCl2+4FeCl2+S,每生成Imol CuCl2,反应中转移电子的数目为2mol 或 1.204×1024;浸取时,在有氧环境下可维持Fe3+较高浓度.有关反应的离子方程式是4Fe2++4H++O2=4Fe3++2H2O.
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见图1.其原因是生成的硫覆盖在Cu2S表面,阻碍浸取.
③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为Cu2S+2CuC12=4CuC1+S、CuCl+FeCl3═CuCl2+FeCl2
(3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图2.转化时正极的电极反应式为2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑.
(4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)?Cu2S(s)+2Cl-(aq),该反应的平衡常数K=5.76×1030[己知Ksp(CuCl)=l.2×l0-6,Ksp(Cu2S)=2.5×l0-43].
分析 (1)根据题给热化学方程式结合盖斯定律可求算C(s)+2Cu2S(s)═4Cu(s)+CS2(g) 的反应热;
(2)①化合价升高元素失电子,化合价降低元素得到电子,化合价升高数=化合价降低数=转移电子数;浸取时,在有氧环境下亚铁离子被氧化为铁离子;
②生成的硫覆盖在Cu2S表面,阻碍浸取;
③353K时,向FeCl3浸取液中加入CuCl2,氯化铜与硫化亚铜反应生成氯化亚铜,氯化亚铜与氯化铁反应生成氯化亚铁和氯化铜;
(3)利用原电池原理,负极失电子发生氧化反应,正极上得到电子发生还原反应;
(4)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,2CuCl(s)+S2-(aq)?Cu2S(s)+2Cl-(aq),结合溶度积计算.
解答 解:(1)①C(s)+S2(g)═CS2(g)△H1=akJ•mol-1
②Cu2S(s)+H2(g)═2Cu(s)+H2S(g)△H2=bkJ•mol-1
③2H2S(g)═2H2(g)+S2(g)△H3=ckJ•mol-1
由①+②×2+③可得:C(s)+2Cu2S(s)═4Cu(s)+CS2(g)的△H=(a+2b+c)kJ•mol-1,
故答案为:a+2b+c;
(2)①反应Cu2S+4FeCl3═2CuCl2+4FeCl2+S,反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,Cu2S中Cu元素的化合价由+1价升高为+2价,硫元素的化合价由-2价升高为0价,化合价升高数=化合价降低数=转移电子数=4,每生成1mol CuCl2,反应中转移电子的数目为2mol 或 1.204×1024,浸取时,在有氧环境下亚铁离子被氧化,生成铁离子,反应的离子方程式为:4Fe2++4H++O2=4Fe3++2H2O,
故答案为:2mol 或 1.204×1024;4Fe2++4H++O2=4Fe3++2H2O;
②浸取过程中,洗涤硫和洗去硫相比较,洗涤硫铜的浸取率偏低,原因为生成的硫覆盖在Cu2S表面,阻碍浸取,
故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
③353K时,向FeCl3浸取液中加入CuCl2,氯化铜与硫化亚铜反应Cu2S+2CuC12=4CuC1+S,生成的氯化亚铜与氯化铁反应CuCl+FeCl3═CuCl2+FeCl2,能加快铜元素的浸取速率,
故答案为:Cu2S+2CuC12=4CuC1+S、CuCl+FeCl3═CuCl2+FeCl2;
(3)由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,正极上得到电子发生还原反应,反应为:2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑,
故答案为:2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑;
(4)Ksp(CuCl)=l.2×l0-6,Ksp(Cu2S)=2.5×l0-43],2CuCl(s)+S2-(aq)?Cu2S(s)+2Cl-(aq),该反应的平衡常数K=$\frac{{C}^{2}(C{l}^{-})}{C({S}^{2-})}$=$\frac{{{K}_{SP}}^{2}(CuCl)}{{K}_{SP}(C{u}_{2}S)}$=$\frac{(1.2×1{0}^{-6})^{2}}{2.5×1{0}^{-43}}$=5.76×1030,
故答案为:5.76×1030.
点评 本题考查了反应热的计算、铁铜的性质、沉淀溶解平衡的计算,难点为(4)的计算,掌握盖斯定律的应用、氧化还原反应原理是解答关键,题目难度中等.

| A. | 用KI滴定FeCl3溶液时可选用淀粉作指示剂 | |
| B. | 向硅酸钠溶液中滴加酚酞,溶液变红,可说明H2SiO3为弱酸 | |
| C. | 除去铜器表面的铜绿[Cu2(OH)2CO3],可用稀硝酸浸泡,再用清水冲洗 | |
| D. | 将浓硫酸加入浓盐酸中可制取氯化氢气体,说明硫酸的酸性比盐酸强 |
| A. | CH2CH=CHCH2CH2Cl | B. | CH3OH | ||
| C. |  | D. |  |
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
| A. | 称取无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 容量瓶中原来留有一点蒸馏水,没有干燥 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
| A | C | |
| B |
(1)写出B、C元素的名称硫、氟.
(2)B位于元素周期表中第3周期第ⅥA族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是H2,质量为0.4g,电解的总反应方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式NH3+HNO3═NH4NO3.
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈紫色.如何观察透过蓝色钴玻璃.