题目内容
9. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |
分析 A、活泼金属钠是负极;
B、“呼出”CO2时,是电解池,而且其极是阳极,钠离子向阴极钠箔移动;
C、“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C;
D、每“呼出”22.4 L CO2,物质的是量为1mol,结合阳极电极反应式2Na2CO3+C-4e-═4Na++3CO2分析解答;
解答 解:A、活泼金属钠是负极,不是正极,故A错误;
B、“呼出”CO2时,是电解池,而且其极是阳极,钠离子向阴极钠箔移动,而不是向多壁碳纳米管移动,故B错误;
C、“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C,故C正确;
D、每“呼出”22.4 L CO2,物质的是量为1mol,结合阳极电极反应式2Na2CO3+C-4e-═4Na++3CO2,所以每“呼出”22.4 L CO2,转移电子数为1.3 mol,故D错误;
故选C.
点评 本题考查电化学的相关知识、电极反应式的书写等知识点,注意电极反应式的书写,为易错点题目难度中等.

练习册系列答案
相关题目
19.含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( )
| A. | NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol-1 | |
| B. | NaOH+HNO3=NaNO3+H2O△H=-28.7kJ•mol-1 | |
| C. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ |
20.为加速漂白粉的漂白作用,最好的方法是( )
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加热干燥使用 | D. | 加入少量稀醋酸 |
17.废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-═N2+3Cl-+2H++3H2O.下列说法中,不正确的是( )
| A. | 反应中氮元素被氧化,氯元素被还原 | |
| B. | 还原性 NH4+>Cl- | |
| C. | 反应中每生成1 mol N2,转移6 mol电子 | |
| D. | 经此法处理过的废水可以直接排放 |
4.设NA为阿伏加德罗常数值,下列叙述正确的是( )
| A. | 46gNO2和N2O4混合气体中氮原子数为NA | |
| B. | 1mol 14C含有的中子数为6NA | |
| C. | 标准状况下,22.4LCCl4中含有的分子数为NA | |
| D. | 0.5molNa2O2与足量水反应,转移电子数为NA |
14.下列化学用语表述正确的是( )
| A. | 二氧化碳的结构式:O=C=O | B. | 氯化氢的电子式: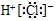 | ||
| C. | ${\;}_{1}^{3}$H的原子结构示意图: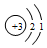 | D. | 水的电离方程式:H2O=H++OH- |
1.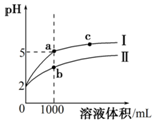 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
18.如图为一种微生物燃料电池结构示意图,下列叙述正确的是( )
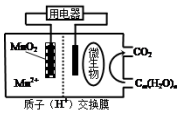

| A. | 放电过程中,电子从正极转移到负极 | |
| B. | 放电过程中,H+从正极区移向负极区 | |
| C. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,消耗的葡萄糖是1mol |
19.下列说法不正确的是( )
| A. | 硫离子的结构示意图: | |
| B. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 | |
| C. | 氧元素位于第2周期VIA族 | |
| D. | 同周期主族元素随着原子序数的递增,原子半径逐渐减小 |