题目内容
17.废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-═N2+3Cl-+2H++3H2O.下列说法中,不正确的是( )| A. | 反应中氮元素被氧化,氯元素被还原 | |
| B. | 还原性 NH4+>Cl- | |
| C. | 反应中每生成1 mol N2,转移6 mol电子 | |
| D. | 经此法处理过的废水可以直接排放 |
分析 2NH4++3ClO-═N2+3Cl-+2H++3H2O中,Cl元素的化合价由+1价降低为-1价,N元素的化合价由-3价升高为0价,以此来解答.
解答 解:A.Cl元素的化合价由+1价降低为-1价被还原,N元素的化合价由-3价升高为0价被氧化,故A正确;
B.2NH4++3ClO-═N2+3Cl-+2H++3H2O中,N元素的化合价由-3价升高为0价,则NH4+为还原剂,Cl元素的化合价由+1价降低为-1价,则生成Cl-为还原产物,所以还原性 NH4+>Cl-,故B正确;
C.N元素的化合价由-3价升高为0价被氧化,所以反应中每生成1 mol N2,转移(3-0l×2×1mol=6 mol电子,故C正确;
D.由2NH4++3ClO-═N2+3Cl-+2H++3H2O得出经此法处理过的废水曾酸性,所以不能直接排放,故D错误;
故选D.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
7.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示,Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Y<W<Z | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的气态氢化物的稳定性比Y的高 |
8.下列叙述正确的是( )
| A. | 用冰冷却苯,苯可以凝结成无色的晶体 | |
| B. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| C. | 在苯中加入酸性 KMnO4 溶液,振荡后静置,上层液体为紫红色 | |
| D. | 1 mol 苯能与 3 mol H2发生加成反应,说明在苯环中含有 3 个双键 |
12.下列物质中分子间能形成氢键的是( )
| A. | HBr | B. | H2S | C. | NH3 | D. | PH3 |
9. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |
6.下列实验操作以及实验现象完全一致的是( )
| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
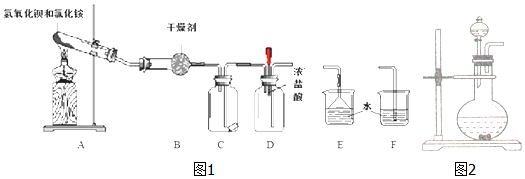
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示: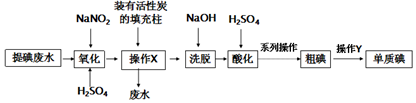
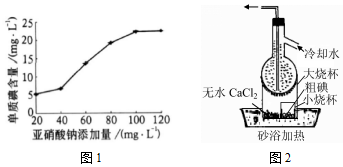 请回答:
请回答: