题目内容
19.含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( )| A. | NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol-1 | |
| B. | NaOH+HNO3=NaNO3+H2O△H=-28.7kJ•mol-1 | |
| C. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ |
分析 n(NaOH)=$\frac{20.0g}{40g/mol}$=0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,结合物质的状态来解答.
解答 解:n(NaOH)=$\frac{20.0g}{40g/mol}$=0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,在溶液中的离子反应,只有水为液体,则该反应的热化学方程式为NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ•mol-1,
故选C.
点评 本题考查热化学方程式的书写,为高频考点,把握焓变、物质的状态、物质的量与热量的关系为解答本题的关键,侧重分析与应用能力的考查,注意中和反应为放热反应,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
9.已知化学方程式:a CuSO4+b FeS2+c H2O=d Cu2S+e FeSO4+f H2SO4,则每当1molCuSO4参加反应,转移的电子数为( )
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 3mol |
10.下列现象不能用“相似相溶”解释的是( )
| A. | 氯化氢易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
7.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示,Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Y<W<Z | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的气态氢化物的稳定性比Y的高 |
14.与100mL 0.4mol•L-1NH4NO3溶液中的NO3-浓度相同的是( )
| A. | 400 mL 0.1 mol•L-1的KNO3溶液 | B. | 100 mL 0.4 mol•L-1的Ba(NO3)2溶液 | ||
| C. | 100 mL 0.2 mol•L-1的Mg(NO3)2溶液 | D. | 200 mL 0.1mol•L-1的Fe(NO3)3溶液 |
4.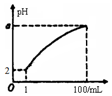 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A. | a的取值范围为2<a<4 | |
| B. | HA溶液加热时,溶液酸性增强 | |
| C. | 与pH=12的NaOH溶液等体积混合后溶液的pH=7 | |
| D. | HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
8.下列叙述正确的是( )
| A. | 用冰冷却苯,苯可以凝结成无色的晶体 | |
| B. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| C. | 在苯中加入酸性 KMnO4 溶液,振荡后静置,上层液体为紫红色 | |
| D. | 1 mol 苯能与 3 mol H2发生加成反应,说明在苯环中含有 3 个双键 |
9. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |