题目内容
1.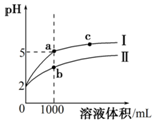 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
分析 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度较大;溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,利用a点、c点溶液中的离子浓度来分析导电性;醋酸浓度大于盐酸,则醋酸中和氢氧化钠溶液的能力强于盐酸;结合升高温度醋酸的电离程度增大分析$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$的变化.
解答 解:A.溶液稀释时,醋酸进一步电离,其溶液中氢离子浓度大于盐酸的离子浓度,故曲线I代表盐酸的稀释过程、II应为醋酸稀释时的pH值变化曲线,故A正确;
B.稀释后盐酸溶液中氯离子、氢离子浓度减小,则溶液导电性较弱,故a溶液的导电性比c溶液的导电性强,故B正确;
C.醋酸的浓度大于盐酸,则a点溶液中和氢氧化钠溶液的能力小于b,故C错误;
D.升高温度后,醋酸的电离程度增大,醋酸根离子浓度增大,而氯离子浓度基本不变,则$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$的比值减小,故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、弱电解质的电离及其影响,题目难度中等,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.下列物质中分子间能形成氢键的是( )
| A. | HBr | B. | H2S | C. | NH3 | D. | PH3 |
9. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |
16.化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响.下列反应的生成物不受上述因素影响的是( )
| A. | 铜与硝酸反应 | B. | 钠与氧气反应 | ||
| C. | 氢气与氯气反应 | D. | 氯化铝与氢氧化钠溶液反应 |
6.下列实验操作以及实验现象完全一致的是( )
| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
13.乙烷混有乙烯,欲除去乙烯得到纯净干燥的乙烷,下列方法正确的( )
| A. | 依次通过溴水、烧碱、浓硫酸 | B. | 依次通过酸性KMnO4溶液、浓硫酸 | ||
| C. | 依次通过澄清石灰水、浓硫酸 | D. | 通入氢气,在一定条件下反应 |
10.把一定量的铁铝合金平均分为两份,分别与足量硫酸和氢氧化钠溶液反应,结果放出H2的物质的量之比是3:1,则合金中铁与铝的物质的量之比为( )
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
11.下列有关能源的说法不正确的是( )
| A. | 煤、石油、天然气、氢能中,其中氢能是可再生能源 | |
| B. | 生物质能包括农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等 | |
| C. | 贮氢合金的发现和应用,解决了氢气贮存、运输的难题 | |
| D. | 生物质能通过直接燃烧产生热量,能量利用效率较高 |