题目内容
14.下列化学用语表述正确的是( )| A. | 二氧化碳的结构式:O=C=O | B. | 氯化氢的电子式: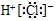 | ||
| C. | ${\;}_{1}^{3}$H的原子结构示意图: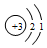 | D. | 水的电离方程式:H2O=H++OH- |
分析 A、二氧化碳中碳原子和氧原子之间以双键结合;
B、HCl为共价化合物;
C、31H原子的质子数为1,核外有一个电子;
D、水是弱电解质,只能部分电离.
解答 解:A、二氧化碳中碳原子和氧原子之间以双键结合,故结构式为O=C=O,故A正确;
B、HCl为共价化合物,是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物,其电子式为 ,故B错误;
,故B错误;
C、31H原子的质子数为1,核外有一个电子,故其结构示意图为 ,故C错误;
,故C错误;
D、水是弱电解质,只能部分电离,故其电离方程式应用可逆号,即为H2O?H++OH-,故D错误.
故选A.
点评 本题考查了常见的化学用语,难度不大,应注意共价化合物和离子化合物电子式书写方法的区别.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
4.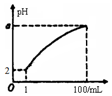 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A. | a的取值范围为2<a<4 | |
| B. | HA溶液加热时,溶液酸性增强 | |
| C. | 与pH=12的NaOH溶液等体积混合后溶液的pH=7 | |
| D. | HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
9. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |
19.苯丙炔酸(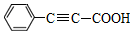 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
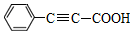 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是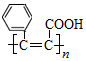 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
6.下列实验操作以及实验现象完全一致的是( )
| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
3.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
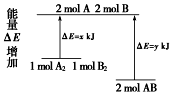

| A. | 该反应的反应热△H=x-y kJ/mol | |
| B. | 断裂1 mol A-A键和1 mol B-B键放出x kJ能量 | |
| C. | 2 mol AB的总能量高于1 mol A2和1 mol B2总能量 | |
| D. | 该反应是吸热反应 |
4.有一包实验室回收的固体粉末,可能含有Na2CO3、NaCl、CuSO4、FeCl3、FeCl2、MgCl2、Na2SO4中的一种或几种,现进行如下实验:
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
| A. | 固体中一定不含有CuSO4、FeCl3 | |
| B. | 固体中一定不含有Na2CO3、一定含有Na2SO4 | |
| C. | 固体中一定含有FeCl2,不一定含有NaCl | |
| D. | 要检验固体中有没有MgCl2,需再取一份溶液,滴加NaOH溶液,若产生白色沉淀,则含有MgCl2 |
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示: