题目内容
17.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.某化学实验小组的同学欲用下列仪器(A-D)制备FeCl3固体.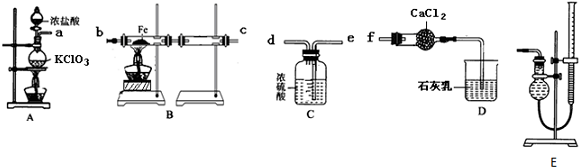
请回答下列问题:
(1)A中发生反应的化学方程式为KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O.
(2)各装置的连接顺序为a→e→d→b→c→f.
(3)实验过程中,给A、B仪器加热的顺序及可作为点燃B处酒精灯的实验标志是:先点然A处酒精灯,反应一段时间后,待整个B装置充满黄绿色气体,再加热B.
(4)B装置的主要缺点是:B装置两硬质玻璃管之间导管太细,易被产品堵塞.
(5)写出装置D中反应的化学方程式2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
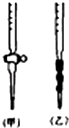
(6)该小组欲用下图所示装置收集尾气,并测量多余气体的体积.
①若右图所示量气装置由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,E图装置中的液体可用饱和氯化钠,收集完气体后,读数前应进行的操作是上下移动滴定管,使左右两边液面相平.
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致体积偏大(填“偏大”、“偏小”或“无影响”).
分析 (1)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水;
(2)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中;
(3)装置中含有空气,B中加热时氧气能与Fe反应,先用氯气排尽装置中空气后,再反应制备氯化铁;
(4)B装置两硬质玻璃管之间导管太细,易被产品堵塞;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水;
(6)①由滴定管的结构,应是碱式滴定管;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应左右两边液面相平;
③第一次与最后读数之差为测定气体的体积,最后读数时俯视右边滴定管液面时,读数偏小,测定气体的体积偏大.
解答 解:(1)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水,反应方程式为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O,
故答案为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O;
(2)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中,各装置的连接顺序为a→e→d→b→c→f,
故答案为:e、d、b、c、f;
(3)装置中含有空气,B中加热时氧气能与Fe反应,先用氯气排尽装置中空气,实验过程中给A、B仪器加热的顺序及可作为点燃B处酒精灯的实验标志是:先点然A处酒精灯,反应一段时间后,待整个B装置充满黄绿色气体,再加热B,
故答案为:先点然A处酒精灯,反应一段时间后,待整个B装置充满黄绿色气体,再加热B;
(4)B装置的主要缺点是:B装置两硬质玻璃管之间导管太细,易被产品堵塞,
故答案为:B装置两硬质玻璃管之间导管太细,易被产品堵塞;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水,反应方程式为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(6)①由滴定管的结构,所用滴定管为碱式滴定管,
故答案为:碱式;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应上下移动滴定管,使左右两边液面相平,保持内外气压相等,
故答案为:饱和氯化钠溶液;上下移动滴定管,使左右两边液面相平;
③滴定管刻度由上而下增大,最后读数时俯视右边滴定管液面时,读数偏小,第一次与最后读数之差为测定气体的体积,测定气体的体积偏大,
故答案为:偏大.
点评 本题考查物质制备实验,涉及氯气制备、对装置的分析评价、信息获取与迁移应用、气体体积测定等,关键是明确实验原理,是对学生综合能力的考查,难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
| A. | 4:10 | B. | 10:4 | C. | 4:1 | D. | 1:4 |
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
| 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中非金属性最强的元素是F,其单质与水反应的化学方程式为2F2+2H2O=4HF+O2;(填写元素符号)
(3)①的氢化物的化学式为NH3,其水溶液呈碱 性,
(4)表中最高价氧化物的水化物呈两性的元素的符号是Al,写出该元素的最高价氧化物的水化物与⑨的最高价氧化物对应水化物反应的化学方程式:Al(OH)3+KOH=KAlO2+2H2O;
(5)用电子式表示②③两种元素形成化合物的过程
 .
. | A. | 把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.