题目内容
6.下表为元素周期表的一部分,请回答有关问题:| 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中非金属性最强的元素是F,其单质与水反应的化学方程式为2F2+2H2O=4HF+O2;(填写元素符号)
(3)①的氢化物的化学式为NH3,其水溶液呈碱 性,
(4)表中最高价氧化物的水化物呈两性的元素的符号是Al,写出该元素的最高价氧化物的水化物与⑨的最高价氧化物对应水化物反应的化学方程式:Al(OH)3+KOH=KAlO2+2H2O;
(5)用电子式表示②③两种元素形成化合物的过程
 .
.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br元素,
(1)⑦和⑩的元素符号是Cl和Br,溴在周期表中的位置是第四周期第ⅦA族;
(2)表中非金属性最强的元素是F,氟与水反应生成氟化氢和氧气;
(3)氮的氢化物是NH3,氨气的水溶液呈碱性;
(4)表中最高价氧化物的水化物呈两性的元素的符号是Al,氢氧化铝与氢氧化钾反应的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O;
(5)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 .
.
解答 解:(1)⑦和⑩的元素符号是Cl和Br,溴在周期表中的位置是第四周期第ⅦA族,故答案为:Cl和Br;第四周期第ⅦA族;
(2)表中非金属性最强的元素是F,氟与水反应的化学方程式为:2F2+2H2O=4HF+O2,故答案为:F,2F2+2H2O=4HF+O2;
(3)氮的氢化物是NH3,氨气的水溶液呈碱性,故答案为:NH3;碱;
(4)表中最高价氧化物的水化物呈两性的元素的符号是Al,氢氧化铝与氢氧化钾反应的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O,故答案为:Al,Al(OH)3+KOH=KAlO2+2H2O;
(5)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查结构性质位置关系应用,题目难度中等,根据题干信息正确判断各元素名称为解答关键,试题侧重对常见化学用语的考查,注意对基础知识的积累掌握.

练习册系列答案
相关题目
14.实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr $\frac{\underline{\;\;△\;\;}}{\;}$ NaHSO4+HBr↑,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见下表:

(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.

| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
1.已知:C(s)+2NO(g)?N2(g)+CO2(g). T℃时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
(1)0~10min以V(NO)表示的平均反应速率为0.042mol/(L•min).
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
11.民以食为天,下列关于厨房调味品的说法正确的是( )
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |
15.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |
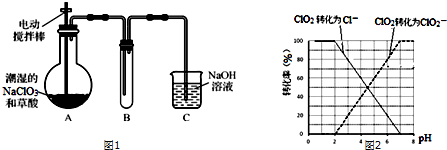
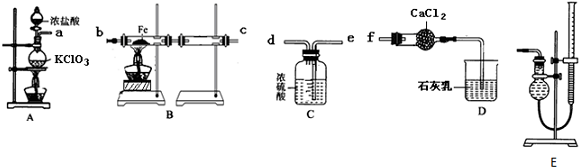
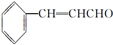 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成: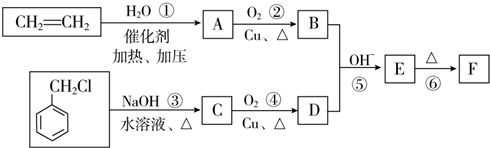
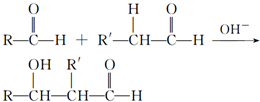
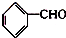 ,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.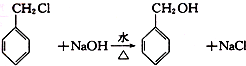 .
.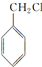 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).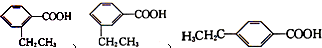 三种任写一种即可.
三种任写一种即可.