题目内容
5. 阅读下列实验内容,根据题目要求回答问题.
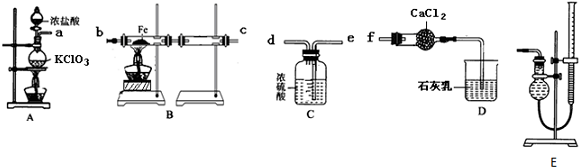
阅读下列实验内容,根据题目要求回答问题.某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol•L-1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗酸式滴定管.
C.用蒸馏水洗干净滴定管.
D. 取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2-3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下.
E.检查滴定管是否漏水.
F.另取锥形瓶,再重复操作一次.
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
①滴定操作的正确顺序是(用序号填写)ECDBAGF(或ECBADGF)
②该滴定操作中应选用的指示剂是酚酞或甲基橙.
③在G操作中如何确定终点?酚酞为指示剂时浅红色变为无色且半分钟不复原(或甲基橙为指示剂时黄色变色橙色且半分钟不复原)
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)偏大.
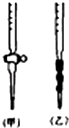
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管乙(选填“甲”或“乙”)中.
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值偏小(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位)4.2mol•L-1.
分析 (1)①根据酸碱中和滴定操作步骤进行排序;
②根据氢氧化钠与硫酸完全反应后溶液呈中性,可选择酚酞或甲基橙;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)甲为酸式滴定管,乙为碱式滴定管,氢氧化钠溶液为碱性溶液,应该用碱式滴定管盛放;
(4)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)先根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度,再根据稀释前后溶质的物质的量不变来计算
解答 解:(1)①用标准0.14mol/L NaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤滴定管、润洗并盛装标准液、润洗盛装标准液的滴定管、盛装标准液、开始滴定、重复滴定等,所以正确的操作顺序为:ECDBAGF(或ECBADGF),
故答案为:ECDBAGF(或ECBADGF);
②氢氧化钠与硫酸完全反应后溶液呈中性,可选择酚酞或甲基橙;
故答案为:酚酞或甲基橙;
③若选择酚酞,观察到锥形瓶中溶液的颜色由浅红色变为无色,达到滴定终点;若选择甲基橙,观察到溶液由黄色变为橙色,则达到滴定终点;
故答案为:酚酞为指示剂时浅红色变为无色且半分钟不复原(或甲基橙为指示剂时黄色变色橙色且半分钟不复原);
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,标准液被稀释,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,滴定结果偏大;
故答案为:偏大;
(3)氢氧化钠溶液呈碱性,应该为碱式滴定管,图1中乙为碱式滴定管,所以应将标准NaOH溶液注入乙中,
故答案为:乙;
(4)从滴定管读数时,滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定c(待测)偏小;
故答案为:偏小;
(5)以0.14mol/L的NaOH溶液滴定上述稀H2SO4 25mL,滴定终止时消耗NaOH溶液15mL,根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度c(H2SO4)=$\frac{\frac{1}{2}×0.14mol/L×0.015L}{0.025L}$=0.042mol/L,待测硫酸(稀释前的硫酸)溶液的物质的量浓度c(H2SO4)=$\frac{0.042mol/L×100mL}{1.00mL}$=4.2mol/L;
故答案为:4.2.
点评 本题考查了酸碱中和滴定实验操作及误差分析,熟记酸碱中和滴定的实验步骤和注意事项,侧重考查学生分析能力和实验能力,题目难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | 木糖醇(  )和葡萄糖( )和葡萄糖( )互为同系物,均 )互为同系物,均属于糖类 | |
| B. | 分子式为C6H14的有机物其一氯代物有三种,此有机物可能是3,3-二甲基丁烷 | |
| C. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| D. | 等质量的乙烯、甲醚、碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量一定不相同 |
| A. | 由水电离出的c(OH-)=1×10-12mol•L-1,pH一定为2 | |
| B. | 将0.02mol•L-1的NaOH溶液.氨水分别稀释a倍、b倍后均得到pH=9的溶液,则a<b | |
| C. | 将pH=1与pH=3的两份盐酸等体积混合后,所得溶液的pH=2(忽略混合时溶液体积的变化) | |
| D. | 等体积的0.2mol•L-1盐酸与0.2mol•L-1氢氧化钡溶液混合后,所得溶液的pH=13(忽略混合时溶液体积的变化) |
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
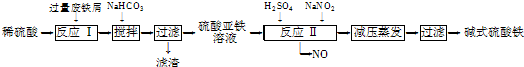
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是4.4-7.5.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是Fe2++H2O2+2H+═Fe3++H2O.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42-+2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
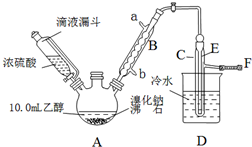
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |