题目内容
19.在4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H20的反应中,氧化剂与还原剂物质的量之比是( )| A. | 4:10 | B. | 10:4 | C. | 4:1 | D. | 1:4 |
分析 在氧化和还原反应4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H20中,Mg元素的化合价升高,被氧化,做还原剂;N元素的化合价降低,被还原,做氧化剂,据此判断氧化剂与还原剂的物质的量之比.
解答 解:在4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H20的反应中,Mg元素的化合价升高,N元素的化合价降低,则该反应的还原剂是Mg,N得到电子被还原,对应还原产物是NH4NO3,则10mol硝酸中只有1mol作氧化剂,
所以该反应中氧化剂与还原剂的物质的量之比是1:4,
故选D.
点评 本题考查了氧化还原反应的计算,题目难度中等,正确判断还原剂的量为解答关键,注意熟练掌握氧化剂、还原剂的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性 HCl>H2SO3 | B. | 金属性 Mg>Al | C. | 碱性 NaOH>Mg(OH)2 | D. | 稳定性 HF>HCl |
10.雾霾天气对环境影响很大.其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
①由表判断NaHSO3溶液显酸性,从原理的角度解释其原因在NaHSO3溶液中HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-两种平衡,HSO3-的电离程度大于其水解程度,故溶液呈酸性.
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.
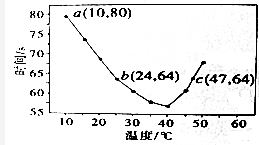
①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.

①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
4.常温下,下列推断正确的是( )
| A. | 由水电离出的c(OH-)=1×10-12mol•L-1,pH一定为2 | |
| B. | 将0.02mol•L-1的NaOH溶液.氨水分别稀释a倍、b倍后均得到pH=9的溶液,则a<b | |
| C. | 将pH=1与pH=3的两份盐酸等体积混合后,所得溶液的pH=2(忽略混合时溶液体积的变化) | |
| D. | 等体积的0.2mol•L-1盐酸与0.2mol•L-1氢氧化钡溶液混合后,所得溶液的pH=13(忽略混合时溶液体积的变化) |
11.下列实验操作、现象与所得结论一致的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
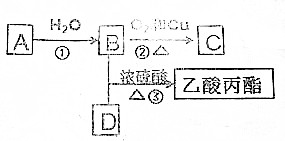
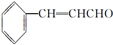 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成: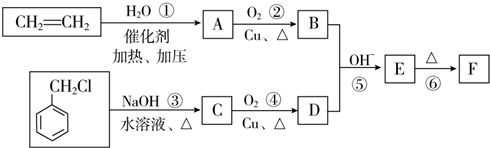
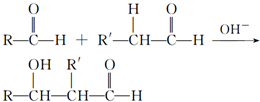
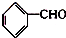 ,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.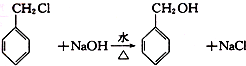 .
.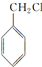 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).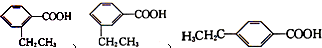 三种任写一种即可.
三种任写一种即可.