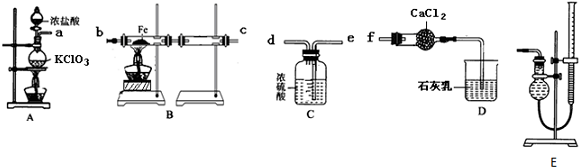
题目内容
2.亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).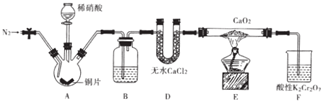
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是排除装置中氧气,防止其将生成的一氧化氮氧化生成二氧化氮.
(2)仪器D的名称是U形干燥管;B中盛放的试剂是蒸馏水.
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是2NO+Cr2O72-+6H+=2Cr3++2NO3-+3H2O.
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明E中有亚硝酸钙生成取少量E中反应后的固体于试管中,滴加少许硫酸,试管口有红棕色气体生成.
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、N02)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO+N02=Ca(N02)2+H2O.
①若n( NO):n(NO2)>l:l,则会导致排放气体中NO含量升高,污染环境:
②若n( NO):n( NO2)<l l,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高.
分析 (1)空气中氧气能氧化一氧化氮干扰实验;
(2)根据仪器的结构来解答;硝酸易挥发,通过蒸馏水洗去硝酸,以防止过氧化钙反应生成氧气;
(3)反应中Cr2O72-被还原成Cr3+,NO氧化成NO3-,根据电子得失守恒与质量守恒配平;
(4)根据Ca(NO2)2与酸会发生反应产生NO气体,NO气体遇氧气生成红棕色NO2气体;
(5)①若n(NO):n(NO2)>1:1,则一氧化氮过量,②若<1:1,则二氧化氮过量;
解答 解:(1)装置中含有空气,空气中氧气能氧化一氧化氮,所以通入氮气的目的是排除装置中氧气,防止其将生成的一氧化氮氧化生成二氧化氮;
故答案为:排除装置中氧气,防止其将生成的一氧化氮氧化生成二氧化氮;
(2)仪器D的名称是U形干燥管;硝酸易挥发,通过B中盛放的蒸馏水洗去硝酸,以防止过氧化钙反应生成氧气;
故答案为:U形干燥管;蒸馏水;
(3)反应中Cr2O72-被还原成Cr3+,NO氧化成NO3-,离子反应方程式为:2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O;
故答案为:2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O;
(4)Ca(NO2)2与酸会发生反应产生NO气体,NO气体遇氧气生成红棕色NO2气体,所以取少量E中反应后的固体于试管中,滴加少许硫酸,试管口有红棕色气体生成即可证明E中有亚硝酸钙生成;
故答案为:取少量E中反应后的固体于试管中,滴加少许硫酸,试管口有红棕色气体生成;
(5)①若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高,污染环境;
②若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2;
故答案为:排放气体中NO含量升高,污染环境;产品Ca(NO2)2中Ca(NO3)2含量升高;
点评 本题考查了制备实验方案的设计,同时考查学生分析问题、解决问题的能力,知道装置的作用、除杂原理、离子方程式的书写、氧化还原反应即可进行解答,难度不大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 丙烯的比例模型为: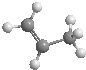 | |
| C. | 1mol物质: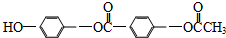 最多能与3mol NaOH反应 最多能与3mol NaOH反应 | |
| D. | CH3CN的电子式为: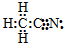 |
| A. | 由水电离出的c(OH-)=1×10-12mol•L-1,pH一定为2 | |
| B. | 将0.02mol•L-1的NaOH溶液.氨水分别稀释a倍、b倍后均得到pH=9的溶液,则a<b | |
| C. | 将pH=1与pH=3的两份盐酸等体积混合后,所得溶液的pH=2(忽略混合时溶液体积的变化) | |
| D. | 等体积的0.2mol•L-1盐酸与0.2mol•L-1氢氧化钡溶液混合后,所得溶液的pH=13(忽略混合时溶液体积的变化) |
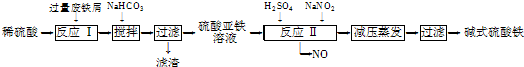
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是4.4-7.5.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是Fe2++H2O2+2H+═Fe3++H2O.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42-聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42-+2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |