题目内容
10.一定条件下,密闭容器中可逆反应:X(g)+Y(g)?Z(g)+W(s):△H>0 已达平衡下列叙述正确的是( )| A. | 保持其它条件不变,加入少量W,平衡将逆向移动 | |
| B. | 保持温度和体积不变,加入少量X,正、逆反应速率均增大 | |
| C. | 保持体积不变,升高温度,正反应速率增大,逆反应速率降低 | |
| D. | 保持温度不变,将体积压缩一半,新平衡时体系压强变为原来的两倍 |
分析 A.W为固体,加入固体对化学平衡无关;
B.保持温度和体积不变,加入少量X,平衡正向进行,达到新平衡状态正逆反应速率大于原来反应速率;
C.反应是吸热反应,升温平衡正向进行,反应速率增大;
D.保持温度不变,将体积压缩一半,压强增大反应前后气体体积减小,所以增大压强平衡正向进行.
解答 解:A.保持其它条件不变,加入少量W,W为固体平衡不移动,故A错误;
B.加入少量X,瞬间正反应速率增大,此时逆反应速率不变,随反应进行,正反应减小,逆反应增大,最后达到平衡状态,正逆反应速率都增大,故B正确;
C.保持体积不变,升高温度,正反应速率增大,逆反应速率增大,故C错误;
D.保持温度不变,将体积压缩一半,压强增大反应前后气体体积减小,所以增大压强平衡正向进行,新平衡时体系压强小于原来的两倍,故D错误;
故选B.
点评 本题考查了化学平衡影响因素、平衡移动原理的理解,注意反应特征和改变的条件,注意固体和纯液体不影响化学平衡,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,则该反应的热化学方程式是( )
| A. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=+92.4KJ/mol | B. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=-92.4KJ/mol | ||
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | D. | H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol |
2.已知:(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol,下列说法中正确的是( )
| A. | 该反应是熵减小的反应 | |
| B. | 该反应是吸热反应,因此不能自发进行 | |
| C. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| D. | (NH4)2CO3(s)比NH4HCO3(s)稳定 |
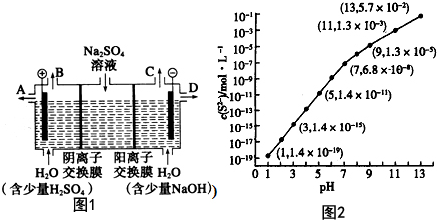
18. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
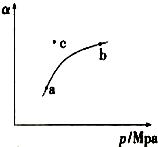
(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
①实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1 ,②温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
19.如图是某同学设计的原电池装置,下列叙述中不正确的是( )
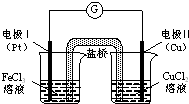

| A. | 电极Ⅰ上发生还原反应,作原电池的正极 | |
| B. | 电极Ⅱ的电极反应式为:Cu-2e-═Cu2+ | |
| C. | 该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
 (NH3·H2O)+c(NH3)=0.1mol·L-1
(NH3·H2O)+c(NH3)=0.1mol·L-1 原氨水中:c(NH4+)+c(H+)=c(OH-)
原氨水中:c(NH4+)+c(H+)=c(OH-)