题目内容
2.已知:(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol,下列说法中正确的是( )| A. | 该反应是熵减小的反应 | |
| B. | 该反应是吸热反应,因此不能自发进行 | |
| C. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| D. | (NH4)2CO3(s)比NH4HCO3(s)稳定 |
分析 A.依据反应的特征分析(NH4)2CO3((s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,反应是熵变增大的反应;
B.反应自发进行的判断依据是△H-T△S<0,反应自发进行;
C.反应能自发,应满足△G=△H-T•△S<0,结合反应的△H和△S进行判断;
D.(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol,可知1mol的NH4HCO3(s)大于1mol(NH4)2CO3(s),能量越低越稳定.
解答 解:A.依据反应的特征分析(NH4)2CO3((s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,反应是熵变增大的反应,△S>0,故A错误;
B.该反应是吸热反应,△H>0,△S>0;反应自发进行的判断依据是△H-T△S<0,当高温下反应可以自发进行,故B错误;
C.根据△G=△H-T•△S判断反应能否自发进行,△H>0,△S>0,在较高温度下可满足△H-T•△S<0,即在较高温度下反应能自发进行;△H<0,△S<0,温度较低时即可满足△H-T•△S<0,能自发进行;△H>0,△S<0,一般情况下△G=△H-T•△S>0,不能自发进行;△H<0,△S>0,可满足△H-T•△S<0,反应能自发进行,故C正确;
D.(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol,可知1mol的NH4HCO3(s)大于1mol(NH4)2CO3(s),能量越低越稳定,因此
NH4HCO3(s)比(NH4)2CO3(s)稳定,故D错误;
故选C.
点评 本题考查了反应自发进行的判断依据,理解自发进行的因素是由焓变和熵变温度共同决定,题目较简单.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
15.足量的铜与含m molH2SO4的浓硫酸共热反应,生成n molSO2气体后,冷却所得溶液,过滤后,给滤液中加入过量的铁粉,则溶解铁粉的质量最多是( )
| A. | 56(m-n)g | B. | 56(n-m)g | C. | 56ng | D. | 56(m-2n)g |
10.一定条件下,密闭容器中可逆反应:X(g)+Y(g)?Z(g)+W(s):△H>0 已达平衡下列叙述正确的是( )
| A. | 保持其它条件不变,加入少量W,平衡将逆向移动 | |
| B. | 保持温度和体积不变,加入少量X,正、逆反应速率均增大 | |
| C. | 保持体积不变,升高温度,正反应速率增大,逆反应速率降低 | |
| D. | 保持温度不变,将体积压缩一半,新平衡时体系压强变为原来的两倍 |
17.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.现用25.00mL 0.04mol/L的羟胺的酸性溶液跟30.00mL 0.02mol/L的KMnO4酸性溶液完全作用.已知MnO4-→Mn2+则在上述反应中,羟胺的氧化产物是( )
| A. | NO | B. | N2O | C. | N2 | D. | NO2 |
7.下列实验能达到预期目的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行,以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用溴水检验石油中是否含有乙烯.
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行,以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用溴水检验石油中是否含有乙烯.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
13.在一密闭容器中,反应aA?bB达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则( )
| A. | A与B一定都是气体 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b |
11. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O
(3)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;\;\;光\;\;\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0
水蒸气的浓度(mol•L-1)随时间t (min)变化如下表:
可以判断:实验①的前20 min的平均反应速率 ν(O2)=3.5×10-5mol/(L.min);;实验温度T1<T2(填“>”“<”);催化剂的催化效率:实验①<实验②(填“>”、“<”).
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O
(3)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;\;\;光\;\;\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0
水蒸气的浓度(mol•L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是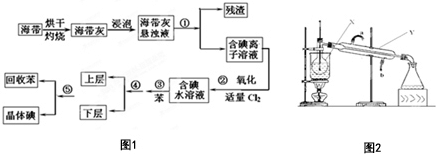 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2)
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2)