题目内容
15.硫及其化合物在工、农业生产和科学实验中均有很广泛的用途.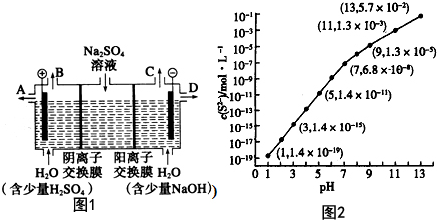
(1)S的基态原子核外电子排布式为1S22S22P63S23P4.
(2)模拟工业上离子交换膜法制烧碱的方法,利用如图1装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠.①该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑.
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)D导出.
(3)25℃,在0.10mol/LH2S溶液中,通入HCl或加入NaOH以调节溶液pH,溶液pH与c(S2-)关系如图2所示(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol/L.
②某溶液含0.020mol/L Mn2+、0.10mol/L H2S,当溶液pH=5时,Mn2+开始沉淀.
[已知:Ksp(MnS)=2.8×10-13]
(4)已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7;HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
室温下,0.1mol/L Na2SO3溶液的pH<0.1mol/LNaClO溶液的pH(填“>”、“<”
或“=”).浓度均为0.1mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
分析 (1)硫S的基态原子核外未成对电子处于3p轨道,共2个未成对电子;
(2)①电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②根据氢氧化钠生成的电极判断导出口;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
(4)①酸的电离平衡常数越小,其对应的酸根离子水解程度越大,则相同浓度的钠盐溶液的pH越高;
②根据电离平衡常数知,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,弱酸根离子都水解但程度都较小,据此判断各离子浓度大小.
解答 解:(1)硫原子核电荷数为16,最外层电子数为6,S的基态原子核外电子排布式为:1S22S22P63S23P4,
故答案为:1S22S22P63S23P4;
(2)①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②氢氧化钠在阴极生成,所以在D口导出;故答案为:D;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
(4)H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/LNa2SO3溶液的pH小于0.1mol/L NaClO溶液的pH,电离平衡常数:H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,这些弱酸根离子都水解但程度都较小,所以SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:<;c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

 天天练口算系列答案
天天练口算系列答案温度为T时,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50s的平均速率v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
| A. | 保持其它条件不变,加入少量W,平衡将逆向移动 | |
| B. | 保持温度和体积不变,加入少量X,正、逆反应速率均增大 | |
| C. | 保持体积不变,升高温度,正反应速率增大,逆反应速率降低 | |
| D. | 保持温度不变,将体积压缩一半,新平衡时体系压强变为原来的两倍 |
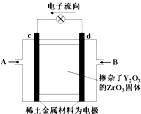 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )| A. | c电极名称为负极,气体A为空气 | |
| B. | d电极上发生反应:CH4-8e-+4O2-═CO2+2H2O | |
| C. | O2-向c电极移动 | |
| D. | 用此装置作电源电解精炼铜,d电极与粗铜相连 |
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行,以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用溴水检验石油中是否含有乙烯.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
| A. | Cl-的结构示意图: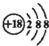 | |
| B. | NaClO的电子式: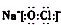 | |
| C. | 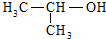 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$ I |
 (PCl3) / mol
(PCl3) / mol