题目内容
19.下列说法不正确的是( )| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是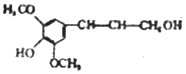 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
分析 A.现象不同能鉴别物质,溴水与苯、四氯化碳、乙烯、乙醇、苯酚作用,现象不同;
B.分子式为C4H10O的醇的种类取决于-C4H9的种类,-C4H9异构体有4种:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,然后确定酯的种类;
C.淀粉与纤维素均是多糖,水解最终产物均是单糖,二糖、淀粉、纤维素水解的最终产物都是单糖,但不一定是葡萄糖;
D.芥子醇中含有酚羟基,具有酸性,可发生取代反应,含有C=C,可发生加成、加聚、氧化反应,具有烯烃的空间结构.
解答 解:A.苯、四氯化碳、乙烯、苯酚溶液四种无色液体与溴水混合的现象分别为:分层后有色层在上层、分层后有色层在下层、溶液褪色白色沉淀,现象不同,能鉴别,故A正确;B.乙二酸无同分异构体,C4H10O的醇有四种,从四种醇中选取2个与乙二酸形成酯,故形成的二元酯有4+3+2+1=10种,故B正确;
C.淀粉与纤维素均是多糖,水解最终产物均是单糖中的葡萄糖,二糖水解产物可能不止一种,如蔗糖水解生成葡萄糖和果糖,故C错误;
D.该有机物含有苯环和碳碳双键,与它们相连的碳原子可能在同一个平面上,能与溴发生反应的自由碳碳双键,则芥子醇与足量浓溴水反应,最多消耗1 mol Br2,故D正确;
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物的组成以及官能团的性质,为解答该类题目的关键.

练习册系列答案
相关题目
3.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备l,2-二溴乙烷的装置如右图所示,有关数据如表:
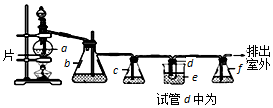
回答下列问题:
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的下层.(填“上”或“下”)
(3)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型),其化学方程式 .
.
②加成反应(填反应类型).

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的下层.(填“上”或“下”)
(3)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型),其化学方程式
 .
.②加成反应(填反应类型).
10.下列说法正确的是( )
| A. | 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 | |
| B. | 加水稀释0.1 mol•L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 | |
| C. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
7.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
14.下列离子方程式书写不正确的是( )
| A. | 氨气通入醋酸溶液中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向苯酚纳溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 等物质的量Cl2与FeBr2在溶液反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 惰性电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
4.下列关系中正确的是( )
| A. | 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr | |
| B. | 常温下,浓度为0.1mol•L-1的HA溶液(Ka=10-5)pH≈3 | |
| C. | c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) | |
| D. | 25℃时,向10mL0.01mol•L-1KOH溶液中滴加10mL0.01mol•L-1的醋酸溶液后,混合液中:c(K+)>c(CH3COO-)>c(OH-)=c(H+) |
11. 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )| A. | 电极Ⅱ为阳极,发生还原反应 | |
| B. | 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大 | |
| C. | 阴极区电极反应式为:2SO2+2e-═S2O42- | |
| D. | 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L |
15.下列四组能形成原电池且放电后,正极有金属析出的是( )
| A. | Cu、Ag、AgNO3溶液 | B. | Zn、Cu、稀硫酸 | ||
| C. | Fe、Zn、CuSO4溶液 | D. | Fe、C、Fe2(SO4)3溶液 |
10.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、NO3- | ||
| C. | K+、OH-、NO3-、HSO3- | D. | Mg2+、NH4+、Cl-、SO42- |