题目内容
7.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
分析 A、在标准状况,依据n=$\frac{V}{Vm}$计算物质的量结合乙烷分子结构计算共价键;
B、H2+Cl2=2HCl,这是一个气体体积不变的反应,故反应前气体分子总数目为2NA,反应后气体分子总数目仍为2NA;
C、据铝反应后变为+3价来分析;
D、求出H2S的物质的量,然后根据H2S溶于水后部分电离为HS-和S2-离子来分析.
解答 解:A、标准状况下,11.2L的 C2H6物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,1mol分子中含有共价键的数目为7NA,故0.5mol分子中含有共价键的数目为3.5NA,故A正确;
B、2.0 g H2相当于1molH2,1molH2和1 mol Cl2气体总分子数目为2NA,H2+Cl2=2HCl,这是一个气体体积不变的反应,故反应前气体分子总数目为2NA,反应后气体分子数目仍为2NA,故B正确;
C、Al与足量的盐酸,足量的NaOH反应,铝均变为+3价,故1mol铝转移3mol电子即3NA个,故C正确;
D、标况下3.4gH2S的物质的量为0.1mol,而H2S是弱电解质,溶于水后只能部分电离为HS-和S2-离子,故所得溶液中的H2S、HS-和S2-离子的个数之和为0.1NA个,故D错误,
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
11.粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式6H++Fe2O3=2Fe3++3H2O.
②初步分离得到的滤渣主要成分是SiO2.
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合表分析其原因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离.
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为3NH3•H2O+Al3+=Al(OH)3+3NH4+.
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5,选择该范围的理由是铝元素沉淀较多,铁元素还没有开始大量的沉淀.

Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3.
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是冷却、结晶.
(2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式6H++Fe2O3=2Fe3++3H2O.
②初步分离得到的滤渣主要成分是SiO2.
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合表分析其原因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离.
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
①氨水使滤液中铝离子沉淀的离子方程式为3NH3•H2O+Al3+=Al(OH)3+3NH4+.
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5,选择该范围的理由是铝元素沉淀较多,铁元素还没有开始大量的沉淀.

Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3.
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是冷却、结晶.
(2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
18.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
15.下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的是( )
| A. | 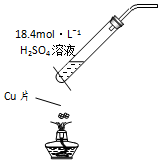 用图装置制取SO2 | |
| B. | 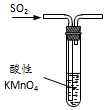 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 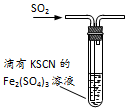 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
12.化学与社会都密切相关,下列说法正确的是( )
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
19.下列说法不正确的是( )
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是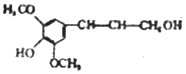 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
3.下列物质属于电解质的是( )
| A. | 稀盐酸 | B. | 二氧化碳 | C. | 酒精 | D. | 硫酸钡 |