题目内容
15.下列四组能形成原电池且放电后,正极有金属析出的是( )| A. | Cu、Ag、AgNO3溶液 | B. | Zn、Cu、稀硫酸 | ||
| C. | Fe、Zn、CuSO4溶液 | D. | Fe、C、Fe2(SO4)3溶液 |
分析 原电池放电后,正极有金属析出,说明正极为金属阳离子得电子生成金属单质,据此结合选项分析.
解答 解:A、Cu、Ag、AgNO3溶液构成原电池,Cu为负极,银为正极,正极为银离子得电子生成银单质,故A正确;
B、Zn、Cu、稀H2SO4构成原电池,Zn为负极,铜为正极,正极为氢离子得电子生成氢气,故B错误;
C、Fe、Zn、CuSO4溶液,Zn为负极,Fe为正极,正极为铜离子得电子生成铜单质,故C正确;
D、Fe、C、Fe2(SO4)3溶液构成原电池,Fe为负极,C为正极,正极上三价铁离子得电子生成二价铁离子,正极上没有金属单质生成,故D错误;
故选AC.
点评 本题考查了原电池原理的应用,注意把握正负极的判断及电极上发生的反应,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
18.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法不正确的是( )
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是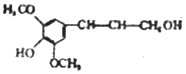 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
3.下列物质属于电解质的是( )
| A. | 稀盐酸 | B. | 二氧化碳 | C. | 酒精 | D. | 硫酸钡 |
10.下列各组互为同位素的是( )
| A. | O2和O3 | B. | CO和CO2 | C. | H2O和H2O2 | D. | 24Mg和26Mg |
20.下列有关化学用语表述正确的是( )
| A. | 1H、2H、3H互为同素异形体 | |
| B. | H2S分子中的化学键为非极性共价键 | |
| C. | S2-的结构示意图: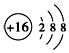 | |
| D. | NH4Cl的电子式: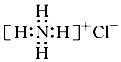 |
7.下列关于晶体的说法正确的是( )
| A. | 离子晶体中一定含金属阳离子 | |
| B. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| C. | 分子晶体的熔点不一定比金属晶体的熔点低 | |
| D. | 在共价化合物分子中,各原子都形成8电子结构 |
19.下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na2CO3•10H2O晶体久置后变成白色粉末 | Na2CO3•10H2O与空气中的CO2作用生成 NaHCO3 |
| B | 青铜(铜锡合金)在空气中久置表面会生成一层铜绿 | 发生电化学腐蚀,铜做负极 |
| C | 将过量SO2通入到KMnO4溶液中,溶液褪色 | SO2具有还原性,与 KMnO4发生氧化还原反应 |
| D | 向含有酚酞的 Na2CO3溶液中加入BaCl2固体, 溶液红色变浅 | Na2CO3溶液中的电离平衡发生移动 |
| A. | A | B. | B | C. | C | D. | D |