题目内容
10.水溶液中能大量共存的一组离子是( )| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、NO3- | ||
| C. | K+、OH-、NO3-、HSO3- | D. | Mg2+、NH4+、Cl-、SO42- |
分析 离子之间不反应生成气体、沉淀、弱电解质、络合物或发生氧化还原反应、互促水解反应就能大量共存,以此解答该题.
解答 解:A.Ba2+、SO42-反应生成沉淀而不能大量共存,故A错误;
B.Fe2+、S2-在酸性条件下与NO3-发生氧化还原反应而不能大量共存,故B错误;
C.OH-、HSO3-反应生成水和SO32-而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存,为高考热点,明确离子反应条件是解本题关键,注意题干中限制性条件,还常常考查离子颜色、溶液酸碱性、氧化还原反应、络合反应等,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列说法不正确的是( )
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是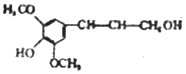 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
7.下列关于晶体的说法正确的是( )
| A. | 离子晶体中一定含金属阳离子 | |
| B. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| C. | 分子晶体的熔点不一定比金属晶体的熔点低 | |
| D. | 在共价化合物分子中,各原子都形成8电子结构 |
5.下列叙述中能肯定说明金属 A 比金属 B 的活泼的是( )
| A. | A 原子最外层电子数比 B 原子的最外层电子数少 | |
| B. | A 原子电子层数比 B 原子的电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的 H2比 1mol B从酸中置换生成的 H2多 |
15.下列化学方程式或离子方程式正确的是( )
| A. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| B. | 乙醇溶液中加入新制碱性Cu(OH)2悬浊液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| C. | 乙醇和浓硫酸混合加热至140℃:CH3CH2OH$→_{140℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
2.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
19.下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na2CO3•10H2O晶体久置后变成白色粉末 | Na2CO3•10H2O与空气中的CO2作用生成 NaHCO3 |
| B | 青铜(铜锡合金)在空气中久置表面会生成一层铜绿 | 发生电化学腐蚀,铜做负极 |
| C | 将过量SO2通入到KMnO4溶液中,溶液褪色 | SO2具有还原性,与 KMnO4发生氧化还原反应 |
| D | 向含有酚酞的 Na2CO3溶液中加入BaCl2固体, 溶液红色变浅 | Na2CO3溶液中的电离平衡发生移动 |
| A. | A | B. | B | C. | C | D. | D |
20.下列关于有机化合物的说法不正确的是( )
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |