题目内容
11. 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )| A. | 电极Ⅱ为阳极,发生还原反应 | |
| B. | 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大 | |
| C. | 阴极区电极反应式为:2SO2+2e-═S2O42- | |
| D. | 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L |
分析 电极Ⅰ极上SO2生成Na2S2O4,S元素化合价由+4价降低到+3价,发生还原反应,应为阴极,电极反应式为:2SO2+2e-═S2O42-,连接电源的负极,电极Ⅱ上二氧化硫被氧化生成硫酸,为阳极,电极反应式为2H2O+SO2-2e-═4H++SO42-,连接电源的正极,以此解答该题.
解答 解:A.电极Ⅱ上二氧化硫被氧化生成硫酸,为阳极发生氧化反应,故A错误;
B.通电后H+通过阳离子交换膜向阴极电极Ⅰ方向移动,电极Ⅱ二氧化硫被氧化生成硫酸,电极反应式为2H2O+SO2-2e-═4H++SO42-,酸性增强pH减小,故B错误;
C.电极Ⅰ极为阴极,发生还原反应SO2生成Na2S2O4,电极反应式为:2SO2+2e-═S2O42-,故C正确;
D.由阴极电极反应式为:2SO2+2e-═S2O42-,阳极电极反应式为:2H2O+SO2-2e-═4H++SO42-,则若通电一段时间后溶液中H+转移0.1mol,则阴阳两极共处理标准状况下SO2废气(0.1+0.05)mol×22.4L/mol=3.36L,故D错误.
故选C.
点评 本题考查电解池原理,为高频考点,侧重于学生的分析能力的考查,注意把握电解池的工作原理,难点的电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
1.以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
| A. | 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 | |
| D. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
19.下列说法不正确的是( )
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是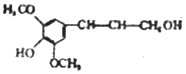 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
3.下列物质属于电解质的是( )
| A. | 稀盐酸 | B. | 二氧化碳 | C. | 酒精 | D. | 硫酸钡 |
10.下列各组互为同位素的是( )
| A. | O2和O3 | B. | CO和CO2 | C. | H2O和H2O2 | D. | 24Mg和26Mg |
7.下列关于晶体的说法正确的是( )
| A. | 离子晶体中一定含金属阳离子 | |
| B. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| C. | 分子晶体的熔点不一定比金属晶体的熔点低 | |
| D. | 在共价化合物分子中,各原子都形成8电子结构 |
2.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |



 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 .
. .此空多余
.此空多余 可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$ .
.