题目内容
3.下列叙述正确的是( )| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
分析 A.一水合氨为弱电解质,部分电离,应用可逆号;
B.硫氢氢钠为强电解质,完全电离,用等号;
C.铝离子水解生成少量氢氧化铝,不标注沉淀符号;
D.四氯化钛与水反应生成二氧化钛和氯化氢.
解答 解:A.氨水使酚酞溶液变红的原因,离子方程式:NH3•H2O?NH4++OH-,故A错误;
B.硫酸氢钠溶液显酸性,离子方程式:NaHSO4=Na++H++SO42-,故B错误;
C.明矾净水原理,离子方程式:Al 3++3 H2O?Al(OH)3+3 H+,故C错误;
D.制备TiO2纳米粉,化学方程式:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl,故D正确;
故选:D.
点评 本题考查了离子方程式、化学方程式的书写,侧重考查盐类水解、弱电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
相关题目
13.NA代表阿伏伽德罗常数的值.K35ClO3与H37Cl反应后生成氯气、氯化钾和水.下列说法正确的是( )
| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
14.氙气和氟气按一定比例混合,在一定条件下可直接反应达到如下平衡Xe(g)+2F2(g)?XeF4(g)△H<0;下列变化既能加快反应速率又能使平衡向逆反应方向移动的是( )
| A. | 减压 | B. | 加压 | C. | 适当降温 | D. | 升高温度 |
11.下列实验可达到实验目的是( )
| A. | 将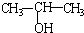 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸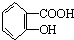 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
8.在一定温度下,将少量生石灰放入到一定量的饱和石灰水中,搅拌并冷却到原来的温度下列说法正确的是( )
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
15.在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度最接近于( )
| A. | $\frac{1}{2}$(10-9+10-11)mol/L | B. | 2×10-11 mol/L | ||
| C. | (10-9+10-11)mol/L | D. | $\frac{1}{2}$(10-5+10-3)mol/L |
13.下列关于阿佛加德罗常数的说法正确的是( )
| A. | 0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 | |
| B. | 一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA | |
| C. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| D. | 1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |