题目内容
12.现有下列九种物质:①H2 ②Cu ③CuO ④CO2⑤稀H2SO4 ⑥稀硝酸 ⑦氨水 ⑧Ba(OH)2固体 ⑨熔融Al2(SO4)3,请回答下列问题.(前3个小题填写物质的序号)(1)上述物质中,属于强碱的是⑧;
(2)上述物质中,在该状态下既是电解质又能导电的是⑨;
(3)上述物质或溶液中若两两反应的离子方程式为:H++OH-═H2O则,对应的两种物质是⑥⑧;
(4)上述两种物质的组合后在一定条件下能发生置换反应,请写出其化学方程式是H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(5)在⑧的溶液中通入少量的④,请写出该反应的离子方程式:Ba2++2OH-+CO2═BaCO3↓+H2O.
(6)在特殊条件下,金属Al与⑥发生反应的化学方程式为:8Al+30HNO3═8Al(NO3)3+3X+9H2O,该反应中生成的X是一种盐,其化学式为NH4NO3,其中还原剂与氧化剂的物质的量之比是8:3,当有8.1g Al发生反应时,转移电子的数目为0.9NA.
分析 (1)依据碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物分析,K、Na、Ba、Ca的阳离子与氢氧根形成的是强碱;
(2)能导电的电解质处于熔融状态下;
(3)离子方程式为H++OH-═H2O,是强酸强碱反应生成溶于水的盐和水分析判断;
(4)一种单质与一种化合物反应生成另外一种单质与另外一种化合物,属于置换反应;
(5)氢氧化钡溶于水形成的溶液中通入少量的二氧化碳气体生成碳酸钡;
(6)依据氧化还原反应电子守恒和原子守恒计算分析产物中氮元素化合价,得到X化学式,元素化合价升高的做还原剂,元素化合价降低的为氧化剂,结合化学方程式计算得到;依据化学方程式中电子转移计算得到电子转移数.
解答 解:(1)氨水和氢氧化钙固体均是碱,前者是弱碱,后者是强碱,故答案为:⑧;
(2)熔融状态下能导电的化合物,属于电解质,故答案为:⑨;
(3)硝酸与氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水,可以用离子方程式H++OH-═H2O表示,对应反应为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:⑥⑧;
(4)氢气还原氧化铜为置换反应,故答案为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(5)在⑧Ba(OH)2固体的溶液中通入少量的④CO2,反应生成碳酸钡,反应的离子方程式Ba2++2OH-+CO2═BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2═BaCO3↓+H2O;
(6)8Al+30HNO3=8Al(NO3)3+3X+9H2O,设氮元素化合价降低为x,依据氧化还原反应电子守恒,8×3=3(5-x)得到x=-3,依据原子守恒则生成的产物NH4NO3;8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O,8molAl做还原剂与3molHNO3做氧化剂的物质的量之比是=8:3,216gAl反应转移电子物质的量为24mol,当有8.1g Al发生反应时,转移电子的物质的量=$\frac{8.1g×24mol}{216g}$=0.9mol,
故答案为:NH4NO3;8:3;0.9NA.
点评 本题考查了电解质、非电解质的判断,离子方程式书写、物质的量的计算,明确相关概念、离子方程式的意义是解题关键.

| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
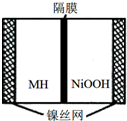 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
下列关系式中正确的是( )
| A. | b<a<0 | B. | b>a>0 | C. | a=b<0 | D. | a=b>0 |
 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.(1)测定目的:测定某品牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:①仪器:(自选,略).
试剂:指示剂淀粉溶液(填名称)、浓度为7.5×10-3 mol•L-1的标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(或移液管)(填仪器名称)向锥形瓶中量入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点,滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
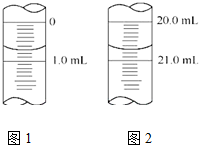
(5)数据记录与处理:如图1为某一次滴定管滴定前液面,其读数值为0.70mL图2为滴定结束液面,则本次滴定过程共使用了20.00mL标准碘溶液
几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(6)问题讨论:取标准碘溶液的滴定管洗涤之后直接装液开始滴定,则测定结果偏高.(填“偏高”、“偏低”、“无影响”)
| A. | R的氢化物比Y的氢化物的沸点更高 | |
| B. | X与Z组成的化合物溶于水呈碱性 | |
| C. | 只有Y元素存在同素异形体 | |
| D. | X、Y、Z、R形成简单离子的半径依次增大 |

| A. | 装置甲可用于检验乙烯生成 | |
| B. | 装置乙可用于收集和吸收氨气 | |
| C. | 装置丙可用于出去CO2中混有的SO2气体 | |
| D. | 装置丁可分离碘的CCl4溶液 |



