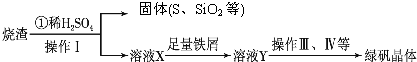
题目内容
13.NA代表阿伏伽德罗常数的值.K35ClO3与H37Cl反应后生成氯气、氯化钾和水.下列说法正确的是( )| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
分析 反应的方程式为K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,生成的Cl2中,35Cl与37Cl个数比为1:5,结合元素的化合价的变化计算.
解答 解:A.生成的Cl2中,35Cl与37Cl个数比为1:5,则氯气的相对分子质量为2×$\frac{1×35+5×37}{6}$=73.3,故A错误;
B、由化合价的变化可知,生成1 mol氯化钾转移的电子的物质的量为1mol×(5-0)=5mol,转移的电子数为转移5 NA个电子,故B正确;
C、生成氯化钾的相对分子质量为:37+39=76,所以氯化钾的摩尔质量为76 g/mol,故C正确;
D、由反应方程式可知,6molH37Cl参加反应转移5NA个电子,所以1molH37Cl参加反应转移$\frac{5}{6}$NA个电子,故D错误;
故选BC.
点评 本题考查氧化还原反应的计算,题目难度中等,本题注意元素化合价的变化特点,注意原子的构成,为解答该题的关键,也是易错点,从化合价变化的角度计算转移电子的物质的量.

练习册系列答案
相关题目
4.下列离子检验的方法正确的是( )
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
1.在能使石蕊变红的无色溶液中,可以大量共存的离子组是( )
| A. | Na+、Cu2+、Cl-、NO3- | B. | Na+、K+、SO32-、CO32- | ||
| C. | K+、HCO3-、NO3-、Cl- | D. | Ca2+、Mg2+、NO3-、Cl- |
8.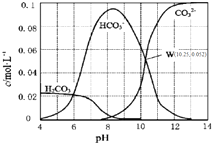 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 向Na2CO3溶液中通入HCl气体,立即产生CO2气体 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成CO2气体224 mL |
18.能正确表示下列化学反应的离子方程式的是 ( )
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
3.下列叙述正确的是( )
| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.