题目内容
14.FeCO3与砂糖混用可作补血剂.以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:
(1)质量分数为30%(密度是1.176g•cm-3)的稀硫酸的物质的量浓度为3.6mol•L-1.
(2)检验滤液A中存在Fe2+的试剂是酸性KMnO4溶液.
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式:Fe+2Fe3+=3Fe2+或Fe+Cu2+=Fe2++Cu.
(4)写出滤液C与NH4HCO3溶液反应的离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(5)FeCO3在空气中灼烧可制得铁系氧化物材料.已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3△H=-1648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ•mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式:4FeCO3(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+4CO2(g)△H=-260kJ•mol-1.
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量NaOH溶液,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝.
分析 本题是利用黄铜矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3)为主要原料,用硫酸溶解后,过滤除去SiO2,滤液用过量的铁粉置换出铜,并调节溶液pH得到Al(OH)3沉淀,通过过滤除去不溶物,得到的滤液主要是硫酸亚铁溶液,硫酸亚铁溶液中加入碳酸氢铵得到碳酸亚铁固体,同时生成二氧化碳和硫酸铵,
(1)可假设硫酸溶液的体积为1L,结合公式c=$\frac{n}{V}$计算硫酸的物质的量浓度;
(2)检验溶液里有无Fe2+,可以用酸性高锰酸钾,亚铁离子能使高锰酸钾溶液褪色;
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀,还可以置换溶液里的铜,也可以将Fe3+还原成Fe2+;
(4)绿硫酸亚铁溶液中加入碳酸氢铵得到碳酸亚铁固体,同时生成二氧化碳和硫酸铵;
(5)根据盖斯定律,将反应①4Fe(s)+3O2(g)═2Fe2O3△H=-1648kJ•mol-1;②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1;③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ•mol-1中,将①-2×③+4×②可得反应4FeCO3(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+4CO2(g),据此书写热化学方程式;
(6)根据上面的分析可知,滤渣D含有铁、铜、氢氧化铝,利用氢氧化铝的两性可以分离,再将氢氧化铝加热分解可得氧化铝;
解答 解:(1)30%的硫酸溶液1L,溶液质量为1000mL×1.176g/cm3=1176g,硫酸的物质的量浓度为 $\frac{\frac{1176g×30%}{98g/mol}}{1L}$=3.6g/mol,故答案为:3.6mol•L-1;
(2)检验溶液里有无Fe2+,可以用酸性高锰酸钾,亚铁离子能使高锰酸钾溶液褪色,故答案为:酸性KMnO4溶液;
(3)铁粉的作用除调节溶液pH外,还能与Cu2+和Fe3+反应,发生反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,故答案为:Fe+2Fe3+=3Fe2+或Fe+Cu2+=Fe2++Cu;
(4)绿硫酸亚铁溶液中加入碳酸氢铵得到碳酸亚铁固体,同时生成二氧化碳和硫酸铵,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(5)根据盖斯定律,将反应①4Fe(s)+3O2(g)═2Fe2O3△H=-1648kJ•mol-1;②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1;③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ•mol-1中,将①-2×③+4×②可得热反应方程式为4FeCO3(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+4CO2(g)△H=-260 kJ•mol-1,
故答案为:4FeCO3(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+4CO2(g)△H=-260 kJ•mol-1;
(6)根据上面的分析可知,滤渣D含有铁、铜、氢氧化铝,在滤渣中加入适量的氢氧化钠,过滤,再向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝,
故答案为:向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝.
点评 本题以实验流程为载体,考查硫及其化合物的性质,涉及氧化还原反应,属基础性考查,难度不大.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 生活污水使用明矾杀菌消毒 | B. | 向燃煤中加入适量石灰石“固硫” | ||
| C. | 推广使用可降解塑料防止白色污染 | D. | 提倡公交出行可减少氮氧化物排放 |
| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |
| A. | 食用松花蛋时蘸些食醋可以去除氨味 | |
| B. | 用双氧水的稀溶液清洗伤口可以杀菌消毒 | |
| C. | 用淀粉溶液检验某食盐是否为加碘盐 | |
| D. | 长期使用含氟牙膏可预防龋齿 |
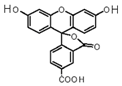 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )| A. | 可与碳酸氢钠溶液反应 | |
| B. | 分子式为C21H12O7 | |
| C. | 1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 | |
| D. | 不与FeCl3发生反应 |
| 选项 | 性质 | 实际应用 |
| A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
| B | SO2具有还原性 | 漂白纸浆 |
| C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暖宝贴 |
| D | 氧化铝是两性氧化物 | 作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |

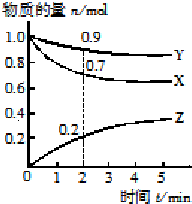 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.