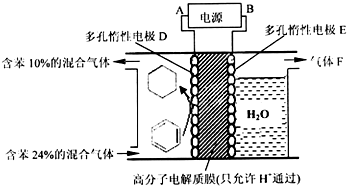
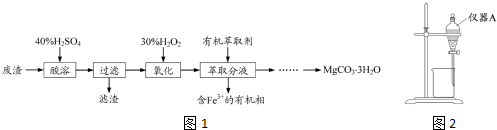
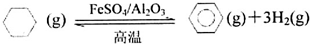题目内容
16. (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.甲.在500℃时,SO2和O2各10mol反应
乙.在500℃时,用V2O5作催化剂、10mol SO2和10mol O2起反应
丙.在450℃时,8mol SO2和5mol O2反应
丁.在500℃时,8mol SO2和5mol O2反应
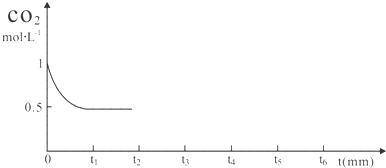
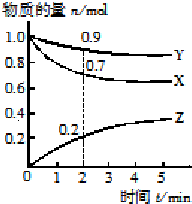
(2)某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式为3X+Y?2Z;
反应开始至2min,Z的平均反应速率为0.05mol/(L•min).
(3)将等物质的量的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)?2HI(g)(正反应放热),反应经过5min测得碘化氢的浓度为0.5mol/L,碘蒸气的浓度为0.25mol/L.请填写以下的空白:
①v(HI)=0.1mol/(L•min);v(H2)=0.05mol/(L•min);氢气的起始浓度=0.5mol/L.
②若上述反应达到平衡,则平衡浓度c(HI)、c(I2)、c(H2)的关系是均为衡量(填“相等”、“2:1:1”或“均为恒量”).
分析 (1)温度越高、浓度越大、使用催化剂均可加快反应速率;
(2)根据图象可知X、Y的量减少是反应物;根据物质的量的变化与化学计量数呈正比书写化学方程式;反应开始至2min,Z的物质的量为0.2mol,以此计算反应速率;
(3)①根据速率之比等于化学计量数之比,结合v(HI),计算v(H2);
根据碘化氢的浓度计算I2的浓度变化量,5min时I2的浓度加I2的浓度变化量等于I2的起始浓度.开始等氢气和碘蒸气的物质的量相等,所以起始浓度相等;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化.
解答 解:(1)由温度可知,丙中反应速率最慢;
温度相同时,乙中使用催化剂,则反应速率最快,
甲与丁比较,甲中浓度大,反应速率快,则按反应速率由大到小的排列顺序为乙、甲、丁、丙,
故答案为:乙甲丁丙;
(2)由图可知,X、Y反应物的物质的量减小,为反应物,Z的物质的量增加,Z为生成物,最后X、Y的物质的量为定值且不为0,说明是可逆反应,Y、Z、X的物质的量变化量之比为(1.0-0.9)mol:(1.0-0.7)mol:0.2mol=1:3:2,物质的量变化量之比等于化学计量数之比,所以反应方程式为:Y+3X?2Z,
反应开始至2min,Z的平均反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:3X+Y?2Z; 0.05mol/(L•min);
(3)①v(HI)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min );
根据速率之比等于化学计量数之比,所以v(H2)=$\frac{1}{2}$v(HI)=$\frac{1}{2}$×0.1mol/(L•min )=0.05mol/(L•min );
I2的浓度变化量△c(I2)=$\frac{1}{2}$△c(HI)=$\frac{1}{2}$×0.5mol/L=0.25mol/L.
所以I2的起始浓度c(I2)=0.25mol/L+0.25mol/L=0.5mol/L.
开始等氢气和碘蒸气的物质的量相等,所以二者起始浓度相等.
所以氢气的起始浓度为0.5mol/L.
故答案为:0.1 mol/(L•min);0.05 mol/(L•min);0.5 mol/L;
②化学反应达到化学平衡状态时,各物质的浓度不再发生变化,所以平衡浓度C(HI)、C(I2)、C(H2)均为恒量,因未给出平衡常数等数据,不能判断浓度的具体关系,
故答案为:均为衡量.
点评 本题考查化学平衡图象分析题目,为高频考点和常见题型,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,试题培养了学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 0.075mol/L | B. | 0.1125mol/L | C. | 0.15mol/L | D. | 0.225mol/L |
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).(1)①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1、K2、K3之间的关系为$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl-N=O);
| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
(3)300℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系
如图A:
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol•L-1•min-1
③T2时该反应的平衡常数K=2.
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
| A. | 12、2.5 | B. | 24、2.5 | C. | 12、3 | D. | 24、3 |