题目内容
5.图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体. (1)图中d的单质对应元素原子的电子排布式是1s22s22p63s23p63d104s1(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个 键,2个 键.
(3)a与b的元素形成的10个电子中性分子X的空间构型为三角锥型;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为[Cu(NH3)4]2+,其中X与d 高价离子之间以配位键相结合.
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子之间形成氢键.
(5)图中C单质的晶体堆积方式类型是体心立方堆积,这种堆积方式晶胞中原子的配位数为8.

分析 Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C,结合对应单质、化合物的结构和性质以及元素周期律的递变规律解答该题,
(1)d为Cu,Cu元素为29号元素,原子核外有29个电子,根据核外电子排布规律来写;
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,C-Hσ键和1个C-N1个σ键和2个π键;
(3)a与b的元素形成的10电子中性分子X为NH3,根据价电子对互斥理论确定微粒的空间构型,与铜离子配位形成四氨合铜络离子;
(4)根据图二可知该酸为HNO3,再根据其结构回答;
(5)C为Na单质的晶体堆积方式类型是体心立方堆积,这种堆积方式晶胞中原子的配位数为8.
解答 解:Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C,
(1)d为Cu,对应元素原子的电子排布式:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N,C-Hσ键和1个C-N1个σ键和2个π键,所以分子中含2个σ键,2个π键,
故答案为:2;2;
(3)a与b的元素形成的10电子中性分子X为NH3,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,将NH3溶于水后的溶液滴入到含Cu元素高价离子的溶液中至过量,Cu2+提供空轨道,氨气分子提供孤对对子,通过配位键形成四氨合铜络离子,其化学式为[Cu(NH3)4]2+,
故答案为:三角锥型;[Cu(NH3)4]2+;配位;
(4)该酸为HNO3,HNO3是极性分子,易溶于极性的水中,并且HNO3分子中的-OH易与水分子之间形成氢键,易溶于水;
故答案为:HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子之间形成氢键;
(5)C为Na单质的晶体堆积方式类型是体心立方堆积,这种堆积方式晶胞中原子的配位数为8,故答案为:体心立方堆积;8.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、配合物等,根据图示推出各对应元素是解答关键,需要学生具备扎实的基础,题目难度中等.

| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
| A. | 放电时,电解质溶液中K+移向负极 | |
| B. | 放电时,电解质溶液的pH 不变 | |
| C. | 充电时,阴极的反应为:Zn(OH)42-+2e-=Zn+4OH- | |
| D. | 充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g |
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 相同温度相同pH的CH3COONa、NaAlO2和NaHCO3三种溶液的物质的量浓度大小为:c(NaAlO2)<c(NaHCO3)<c(CH3COONa) | |
| C. | 0.1 mol/L的NaA溶液和0.1 mol/L的HA溶液等体积混合pH=4.75,则溶液:c (HA)+2c(H+)=2c(OH-)+c(A-) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| A. | NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-=NH3↑+H2O | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O |
 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | 滴入MOH溶液的体积为50ml时,(M+)>(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,则有c(MOH)+(M+)=0.02mol/L |
| A. | 0.075mol/L | B. | 0.1125mol/L | C. | 0.15mol/L | D. | 0.225mol/L |
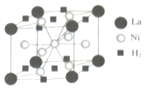 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: 可形成配合物.
可形成配合物. 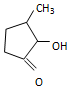 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.