题目内容
6.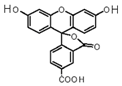 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )| A. | 可与碳酸氢钠溶液反应 | |
| B. | 分子式为C21H12O7 | |
| C. | 1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 | |
| D. | 不与FeCl3发生反应 |
分析 有机物含有羧基,具有酸性,可发生中和、酯化反应,含有酯基、酚羟基,都可与氢氧化钠溶液反应,且酚羟基可与氯化铁反应,以此解答该题.
解答 解:A.含有羧基,可与碳酸氢钠反应,故A正确;
B.由结构简式可知有机物分子式为C21H12O7,故B正确;
C.含有2个酚羟基、1个羧基、1个酯基,则1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠,故C正确;
D.含有酚羟基,可与氯化铁发生颜色反应,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,熟悉有机物中的官能团及物质的性质是解答本题的关键,选项C为解答的易错点,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
16.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
17. 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | 滴入MOH溶液的体积为50ml时,(M+)>(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,则有c(MOH)+(M+)=0.02mol/L |
1.钢铁生锈过程的反应为:①2Fe+O2+2H2O→2Fe(OH)2 ②4Fe(OH)2+O2+2H2O→4Fe(OH)3 ③2Fe(OH)3→Fe2O3+3H2O,下列说法错误的是( )
| A. | 上述反应均为氧化还原反应 | |
| B. | 反应①、②中氧化剂都是氧气 | |
| C. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中通常发生吸氧腐蚀 |
11.五种短周期元素的性质或原子结构信息如表:
请根据表中信息回答下列问题:
(1)Q原子的电子排布式为1s22s22p2,其同位素有12C、13C、14C.
(2)R与Z组成的化合物的化学式是Na2O、Na2O2.
(3)X气态氢化物分子的空间构型为三角锥形.X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有不稳定性和强氧化性.
(4)Y单质与V2O5反应的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(5)在1.01×105Pa、298K时,1.4gQR气体在1.6gR2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
(1)Q原子的电子排布式为1s22s22p2,其同位素有12C、13C、14C.
(2)R与Z组成的化合物的化学式是Na2O、Na2O2.
(3)X气态氢化物分子的空间构型为三角锥形.X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有不稳定性和强氧化性.
(4)Y单质与V2O5反应的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(5)在1.01×105Pa、298K时,1.4gQR气体在1.6gR2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
18.下列说法正确的是( )
| A. | 向25mL沸水中滴加5~6滴FeCl3饱和溶液立刻出现红褐色沉淀 | |
| B. | Na、Mg、AL的最高价氧化物水化物的碱性逐渐增强 | |
| C. | 1-丙醇、2.丙醇的消去产物的核磁共振氢谱图不同 | |
| D. | 2.3gNa与氧气完全反应,转移的电子数为0.1mol |
15.在100mL盐酸、硝酸的混合酸中,HNO3的物质的量浓度为0.2mol/L,HCl的物质的量浓度为0.1mol/L.向其中加入0.96g铜粉微热,待充分反应后,溶液中Cu2+的物质的量浓度约为( )
| A. | 0.075mol/L | B. | 0.1125mol/L | C. | 0.15mol/L | D. | 0.225mol/L |
8.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
