题目内容
下列有关说法正确的是( )
| A、H2O2中只含有极性共价键 |
| B、可用酸性高锰酸钾溶液来区别甲烷和乙烯 |
| C、物质的化学反应与体系的能量变化不一定同时发生 |
| D、铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |
考点:极性键和非极性键,反应热和焓变,原电池和电解池的工作原理,有机物的鉴别
专题:基本概念与基本理论
分析:A、不同非金属元素原子间形成极性键,同种非金属元素原子间形成非极性键;
B、乙烯能使高锰酸钾褪色,甲烷不能;
C、化学反应中一定伴随能量变化;
D、原电池中电子从负极流向正极.
B、乙烯能使高锰酸钾褪色,甲烷不能;
C、化学反应中一定伴随能量变化;
D、原电池中电子从负极流向正极.
解答:
解:A、不同非金属元素原子间形成极性键,同种非金属元素原子间形成非极性键,H2O2中含有O-H键和O-O键,所以既有极性键又有非极性键,故A错误;
B、乙烯能使高锰酸钾褪色,甲烷不能,二者通入高锰酸钾溶液中的现象不同,所以可用酸性高锰酸钾溶液来区别甲烷和乙烯,故B正确;
C、化学反应中反应物断键吸收能量,生成物成键放出能量,所以化学反应中一定伴随能量变化,故C错误;
D、原电池中电子从负极流向正极,铜锌稀硫酸原电池中,Zn作负极,Cu作正极,则电子沿外电路从锌电极流向铜电极,故D错误.
故选B.
B、乙烯能使高锰酸钾褪色,甲烷不能,二者通入高锰酸钾溶液中的现象不同,所以可用酸性高锰酸钾溶液来区别甲烷和乙烯,故B正确;
C、化学反应中反应物断键吸收能量,生成物成键放出能量,所以化学反应中一定伴随能量变化,故C错误;
D、原电池中电子从负极流向正极,铜锌稀硫酸原电池中,Zn作负极,Cu作正极,则电子沿外电路从锌电极流向铜电极,故D错误.
故选B.
点评:本题考查了极性键和非极性键、物质的鉴别、化学反应与能量、原电池,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
在V L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得到白色固体mg,溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列反应中属于氧化还原反应的是( )
| A、CO2+2NaOH═Na2CO3+H2O |
| B、CuO+2HCl═CuCl2+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、2Na+2H2O═2NaOH+H2↑ |
下列关于阿佛加德罗常数(NA)说法正确的是( )
| A、常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2 |
| B、1mol氯气与足量的氢氧化钠反应,共转移了NA的电子 |
| C、标准状况下,2.24L甲烷和氨气的混合气中所含的电子数为NA |
| D、1mol/L的Na2S溶液中,含有的S2-的数目小于NA |
某锂电池的工作原理为LiMOx+Cn=Li1-yMOx+LiyCn(其中M为:Co、Mn、Ni).Li的化合物始终为+1甲,某一极的电极反应式为:LiMOx-ye-=Li1-yMOx+yLi+,则下列说法不正确的是( )
| A、该电池工作时是把化学能转化为电能 |
| B、LiMOx是该电池的负极 |
| C、其正极反应方程式为:LiyCn-ye-=Cn+yLi+ |
| D、手机往往使用锂电池的原因之一为锂是最轻的金属 |
A和B是前三周期的元素,它们的离子A2-、B3+具有相同的电子层结构.下列说法中正确的是( )
| A、原子序数:A>B |
| B、原子半径:A>B |
| C、离子半径:A2->B3+ |
| D、质子数:A>B |
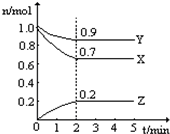 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 消去反应制备Ⅰ的化学方程式为
消去反应制备Ⅰ的化学方程式为 能与CO2发生类似反应②的反应,生成化合物Ⅴ的结构简式:
能与CO2发生类似反应②的反应,生成化合物Ⅴ的结构简式: 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有