题目内容
在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),可以作为反应达到平衡的标志是( )
| A、容器中总压强不随时间变化而变化 |
| B、单位时间内断裂一个A-A键,同时生成两个C-C键 |
| C、v正(B)=0.03mol/(L?s),v逆(D)=1.2mol/(L?min) |
| D、容器中气体的平均相对分子质量不随时间变化而变化 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、两边的计量数相等,所以从反应开始到平衡一直不变,故A错误;
B、只要从反应发生,就具有单位时间内断裂一个A-A键,同时生成两个C-C键,故B错误;
C、v正(B)=0.03mol/(L?s),等效于v正(D)=1.2mol/(L?min),正逆反应速率相等,故C正确;
D、容器中气体的平均相对分子质量始终不随时间变化而变化,故D错误;
故选C.
B、只要从反应发生,就具有单位时间内断裂一个A-A键,同时生成两个C-C键,故B错误;
C、v正(B)=0.03mol/(L?s),等效于v正(D)=1.2mol/(L?min),正逆反应速率相等,故C正确;
D、容器中气体的平均相对分子质量始终不随时间变化而变化,故D错误;
故选C.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
下列化学变化生成物总能量比反应物总能量高的是( )
①生石灰与水反应
②铝与盐酸反应
③氯化铵与Ba(OH)2?8H20反应
④石灰石高温分解
⑤氢气与氧气反应生成H20.
①生石灰与水反应
②铝与盐酸反应
③氯化铵与Ba(OH)2?8H20反应
④石灰石高温分解
⑤氢气与氧气反应生成H20.
| A、①③④ | B、②⑨④ |
| C、②③ | D、③④ |
下列表示物质结构的化学用语或模型图正确的是( )
A、H2O2的电子式: |
B、CH4的球棍模型: |
C、14C的原子结构示意图: |
D、CCl4的结构式: |
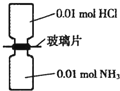 室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的值)( )
室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的值)( )| A、反应前气体的总体积为0.448L |
| B、装置中氢元素的总质量为0.04g |
| C、生成物中含有0.01NA个分子 |
| D、生成物完全溶于水后所得溶液含有0.01 NA个NH4+ |
下列说法中,正确的是( )
| A、1 mol任何气体的体积都约为22.4 L |
| B、标准状况下,含有6.02×1023个原子的气体的体积都约是22.4 L |
| C、常温常压下,2 g氢气所含有的分子数约为6.02×1023 |
| D、标准状况下,1 mol SiO2所占有的体积约为22.4 L |
下列叙述正确的是( )
| A、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” | |||
B、对于可逆反应N2(g)+3H2(g)
| |||
| C、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 | |||
| D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献 |
在V L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得到白色固体mg,溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列反应中属于氧化还原反应的是( )
| A、CO2+2NaOH═Na2CO3+H2O |
| B、CuO+2HCl═CuCl2+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、2Na+2H2O═2NaOH+H2↑ |
 镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.
镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.