题目内容
1.在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2.则原合金中有0.1mol Fe,稀硫酸的物质的量浓度为1.5 mol/L.分析 Fe和Zn合金与稀硫酸发生Fe+H2SO4═FeSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑,由方程式可知n(H2)=n(H2SO4),结合方程式计算.
解答 解:Fe和Zn合金与稀硫酸发生Fe+H2SO4═FeSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑,
设混合物中含有xmolFe、ymolZn,
则x+y=0.3 ①
56x+65y=18.6 ②
解①②得:x=0.1,y=0.2,
n(H2)=n(H2SO4)=0.3mol,
则c(H2SO4)=$\frac{0.3mol}{0.2L}$=1.5mol/L,
故答案为:0.1;1.5
点评 本题考查化学方程式的有关计算,侧重于学生的分析能力和计算能力的考查,注意把握计算的思路,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
11.在某一容积为2L的密闭容器内,加入0.2mol的CO和 0.2mol的 H2O(g),在催化剂存在的条件下恒温下发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=a kJ/mol(a>0).反应达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
| A. | 当体系压强不变时反应一定达到平衡 | |
| B. | 反应放出的热量为 0.2a kJ | |
| C. | 若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 | |
| D. | 在相同条件下再加入0.2mol的CO和0.2mol的 H2O(g),重新达平衡时,c(CO):c(CO2)=3:2 |
12.在标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0.2mol NH3.下列对这四种气体的描述不正确的是( )
| A. | 体积 ②>③>①>④ | B. | 密度 ②>③>④>① | ||
| C. | 质量 ②>③>④>① | D. | 氢原子个数 ①>③>④>② |
9.假如你是卫生防疫人员,为配制0.01mol•L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
| A. | 称量时,左盘高,右盘低 | |
| B. | 定溶时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
13.对下列装置或操作描述正确的是( )
| A. | 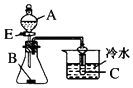 图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 | |
| B. | 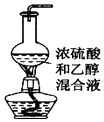 图用于实验室制乙烯 | |
| C. |  图用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| D. | 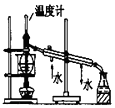 图用于实验室中分馏石油 |
10.下列说法不正确的是( )
| A. | 复分解反应一定不是氧化还原反应 | B. | 置换反应一定是氧化还原反应 | ||
| C. | 化合反应一定是氧化还原反应 | D. | 分解反应不一定是氧化还原反应 |