题目内容
13.对下列装置或操作描述正确的是( )| A. | 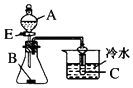 图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 | |
| B. | 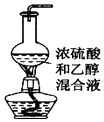 图用于实验室制乙烯 | |
| C. |  图用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| D. | 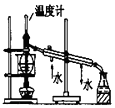 图用于实验室中分馏石油 |
分析 A.发生强酸制取弱酸的反应,但醋酸易挥发;
B.制备乙烯需要在170℃下乙醇发生消去反应;
C.电石与水反应生成的氢氧化钙易堵塞有孔塑料板;
D.温度计测定馏分的温度,且冷却水要下进上出;
解答 解:A.发生强酸制取弱酸的反应,但醋酸易挥发,则图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚,故A正确;
B.制备乙烯需要在170℃下乙醇发生消去反应,图中缺少温度计,不能完成实验,故B错误;
C.电石与水反应生成的氢氧化钙易堵塞有孔塑料板,产生的乙炔可能使试管炸裂,故C错误;
D.温度计测定馏分的温度,且冷却水要下进上出,图中温度计的水银球应在烧瓶支管口处,且冷水方向不合理,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握制备实验、性质实验及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
3.一定温度下,将0.1molAgCl加入1L 0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
| A. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| B. | 约有2×10-5mol AgCl溶解 | |
| C. | 反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
4.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ | |
| B. | 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol | |
| D. | 己知C(s)+O2 (g)=CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2 |
8.下列物质中,能够导电的电解质是( )
| A. | 铜丝 | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | SO3 |
18.下列反应的离子方程式书写正确的是( )
| A. | NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
2.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA | |
| D. | 将0.1mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA |
6.某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片.
实验记录:
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性.
(2)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时可以在溶液中加入少量铁粉以防止亚铁盐被氧化.
(4)检验亚铁盐溶液是否被氧化的操作步骤和现象是取少许亚铁盐溶液于试管中,滴加几滴KSCN溶液,如果溶液变红则说明亚铁盐被氧化.
(5)向FeCl2溶液滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为生成白色沉淀,迅速变成灰绿色,最终变成红褐色,此过程中发生的氧化还原反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片.
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
(2)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时可以在溶液中加入少量铁粉以防止亚铁盐被氧化.
(4)检验亚铁盐溶液是否被氧化的操作步骤和现象是取少许亚铁盐溶液于试管中,滴加几滴KSCN溶液,如果溶液变红则说明亚铁盐被氧化.
(5)向FeCl2溶液滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为生成白色沉淀,迅速变成灰绿色,最终变成红褐色,此过程中发生的氧化还原反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.